L’Angiodisplasia (AD) rappresenta una delle più comuni malformazioni del sistema gastroenterico. Queste vanno ad alterare la struttura vascolare della mucosa intestinale.
La AD rappresenta, nel vasto campo dei sanguinamenti gastrointestinali, dal 1% al 3% dei casi. Maggiormente colpiti sono i soggetti oltre i 60 anni. I sanguinamenti nella AD hanno la caratteristica di recidivare con manifestazioni sempre più importanti nonostante l’utilizzo di terapie mediche convenzionali, di interventi non invasivi come la coagulazione endoscopica e/o chirurgici di resezione.
La malttia di von Willebrand (vWD) è la più comune diatesi emorragica ereditaria causata da un difetto quantitativo o qualitativo del fattore di von Willebrand (vWF). Si stima che abbia una prevalenza del 1% nella popolazione.
Il vWF è una grande proteina multimerica che si rinviene nel sottoendotelio, nelle piastrine e nei megacariciti. La funzione primaria del vWF è di favorire, tramite le glicopreteine di membrana GP1b e GPIIb-IIIa, l’adesione delle piastrine alla struttura vascolare danneggiata del sottoendotelio .
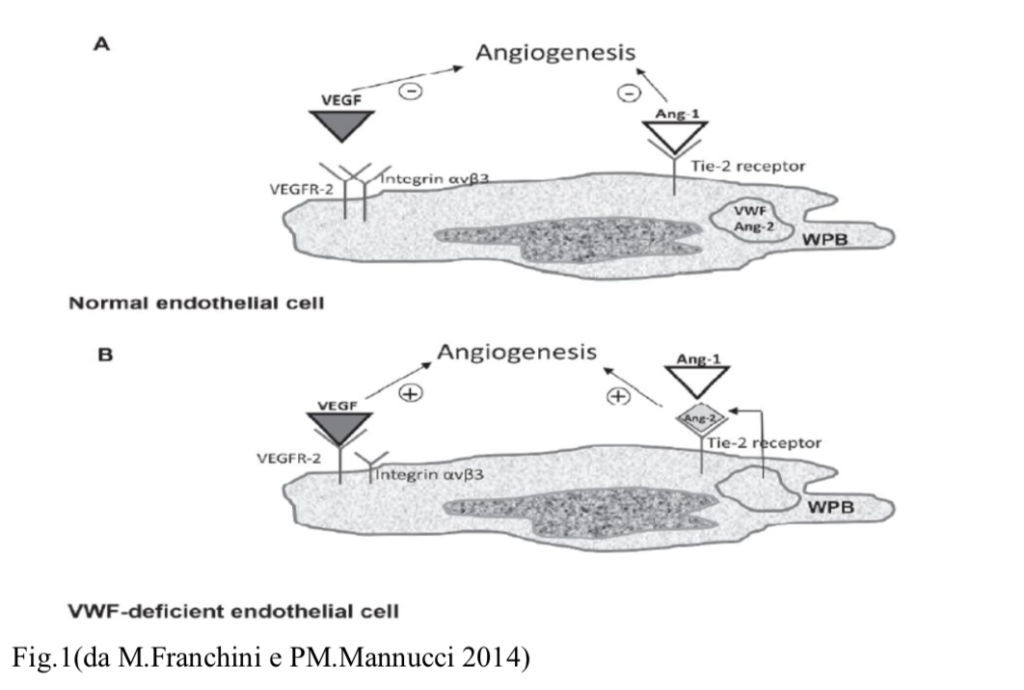
Recentemente è stato documentato il ruolo del vWF nell’angiogenesi e nella riproduzione cellulare nei tumori e nella flogosi. Sembra che il vWF sia coinvolto, con un meccanismo negativo, nella modulazione del recettore vascolare VEGFR-2 del fattore di crescita VEGF (Fig.1). Il risultato sembra consistere in un’aumentata proliferazione e in malformazioni vascolari a carico del tratto gastroenterico . Nel 1993 Fressinaud et al , basandosi su una vasta survey internazionale, ha potuto osservare che l’AD nella VWD ha una incidenza del 1.2% nel tipo 2 , 4.5% nel tipo 3 e del 11%nella VWD acquisita. Mentre la maggior parte degli episodi emorragici in tutti tipi di vWD può essere controllata con la DDAVP, con gli emoderivati ricchi di vWF o con i riconbinanti vWF, i sanguinamenti da AD nel vWD sono molto più difficili da controllare. Le strategie utilizzate quali steroidi, terapie ormonali, immunoglobuline, rFVIIa ed ovviamente concentrati vWF si dimostrano nella maggioranza dei casi inefficaci.
Più recentemente, l’interesse degli investigatori si è focalizzato sull’uso di farmaci con attività regolatoria sull’angiogenesi: l’atorvastatina e la talidomide. Del primo abbiamo pochissime esperienze mentre per la talidomide disponiamo più informazioni. L’attenzione si è soffermata sulla talidomide sulla base di interessanti risultati clinici in un grave disturbo emorragico ereditario come la telangectasia ereditaria. Dunque sembrerebbe che quest’ultimo abbia un effetto immunomodulatore antiangiogenico inibendo il fattore di crescita endoteliale.
Alcuni report indicano che, ad una dose compresa tra 50 e 100 mg al giorno, può essere utile per controllare il sanguinamento refrattario gastrointestinale da angiodisplasia nei pazienti VWD, migliorando il quadro clinico e la riduzione del fabbisogno trasfusionale.
La lenalidomide (Revlimid, CC-5013) è un analogo sintetico della talidomide con le stesse proprietà angiogeniche ma con minor effetti collaterali e con maggior attività biologica. Attualmente viene usato per il trattamento del mieloma multiplo e della sindrome mielodisplastica . La letteratura ha fino ad oggi relegato, in pochi casi, questo approccio come uso off-label per la prevenzione dei sanguinamenti da AD.
NV Khatrit et al. nel 2018 hanno pubblicato un interessante esperienza condotta mediante uno studio osservazionale che ha valutato la lenalidomide come opzione terapeutica a quelle convenzionali. Nello studio sono stati arruolati pazienti con vWD, complicata con AD, caratterizzata da emorragie ricorrenti gastrointestinali che si dimostravano resistenti alla terapia con concentrati vWF ed con antifribrinolitici. I pazienti selezionati avevano la caratteristica di presentare in corso di sanguinamento una caduta dei livelli di Hb superiore ai 2 g/dl (sanguinamento definito maggiore secondo Int.Soc.Throm.Haem.) e la necessità di trasfondere GR concentrati. Ai soggetti arruolati veniva sospesa la terapia antifibrinolitica prima dell’induzione di quella con lenalidomide per evitare un possibile potenziamento del rischio trombotico. Nel periodo di osservazione i concentrati con vWF sono stati usati solo in corso di recidive con sanguinamento importante. Nello studio sono rientrati solo i pazienti che
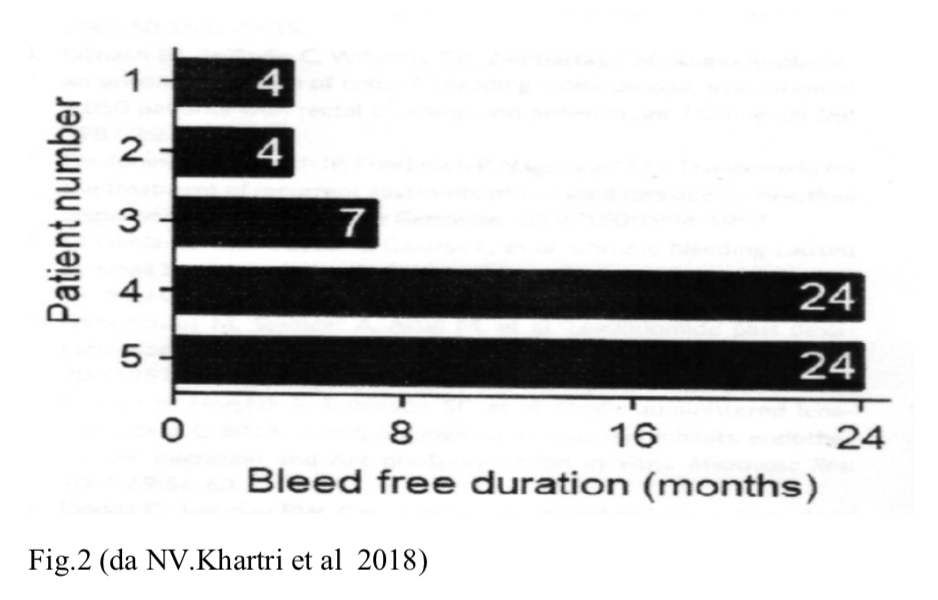
hanno mantenuto il regime terapeutico con lenalidomide per almeno 2 anni così da poter osservare il loro comportamento clinico in confronto al periodo pretrattamento. Cinque sono stati i pazienti valutati che rispettavano i criteri sopra esposti: tre maschi e due donne (68.2+/- 4.9anni), 3 con vWD tipo 3, 1 con tipo 1 ed 1 con tipo 2A. Nei pazienti arruolati l’AD è stata documentata endoscopicamente prima del trattamento con lenalidomide e in tutti interessava i distretti dello stomaco, del duodeno, del digiuno e del colon.
La dose di partenza di lenalidomide per tutti i pazienti è stata di 5mg/die per os. In due pazienti è stato necessario aumentare la dose rispettivamente a 10 e 15 mg/die per una scarsa risposta clinica (importanti e ripetuti episodi di sanguinamento gastrointestinali). Dopo tre settimane di terapia, il regime terapeutico è stato condotto con il seguente schema: una settimana di sospensione e due di terapia per un periodo di due anni. Nel corso dell’osservazione gli unici effetti collaterali registrati sono stati un senso di affaticamento in un caso e di stipsi in un altro caso. Non sono state documentate ciptopenie o complicazioni trombotiche ne altri effetti collaterali. Durante tutto il periodo di trattamento due pazienti non hanno presentato nessun episodio di emorragie gastrointestinali. Negli altri casi l’intervallo, caratterizzato da assenza di sintomatologia, oscillava dai 4 ai 7 mesi. Nella globalità il periodo libero da recidive è stato di 12.6+/- 4.7 mesi (Fig.2).
Questa esperienza dimostrerebbe dunque una buona tollerabilità da parte dei pazienti alla lenalidomide e la sua efficacia clinica nella prevenzione della AD nella vWD. Esperienza sicuramente interessante e promettente che tuttavia richiede ulteriori conferme mediante altri studi prospettici di efficacia e di sicurezza.
Riferimenti
- Danesh BJ, Spiliadis C, Williams CB, Zambartas CM. Angiodysplasia an uncommon cause of colonic bleeding: colonoscopic evaluation of 1.050 patients with rectal bleeding and anaemia J Colorectal Dis. 1987;2:218-222.
- Di Girolamo G,Malvasi A,Cassisa L, et al. Chronic bleeding caused by small bowel angiodysplasia: a problem of recognition and diagnosis. Ital J Gastroenterol.1992;24:468-469.
- Dredge K,Horsfall R,Robinson SP, et al. Orally administrated lenalidomide (CC-5013) is anti-angiogenic in vivo and inhibits andothelial cell migration and akt phosphorylation in vitro. Microvasc Res2005;69:56-63
- Fressinaud E,Meyer D, International survey of patients with von Willebrand disease and angiodysplasia. Thromb Haemost 1993;70:546
- Leebeek Frank WG and Eikeboon Jeroen CJ. Von Willebrand’s disease. NEJM 2016;375:2067-2080.
- Siragusa S, Malato A, Lo Coco L, et al. Gastrointestinal bleeding due to angiodysplasia in patients with type 1 von Willebrand disease: report on association and management. Haemophilia 2008; 14: 150-152.
- Chey WD, Hasler WL, Bockenstedt PL. Angiodysplasia and von Willebrand’s disease type IIB treated with estrogen/progesterone therapy. Am J Hematol 1992; 41: 276-279.
- Bowers M, McNulty O, Mayne E. Octreotide in the treatment of gastrointestinal bleeding caused by angiodysplasia in two patients with von Willebrand’s disease. Br J Haematol 2000; 108: 524-527.
- Franchini M, Frattini F, Crestani S, et al. Novel treatments for epistaxis in hereditary haemorrhagic telangiectasia: a systematic review of the clinical experience with thalidomide. J Thromb Thrombolysis 2013; 36: 355-357.
- Hirri HM, Green PJ, Lindsay J. Von Willebrand’s disease and angiodysplasia treated with thalidomide. Haemophilia 2006; 12: 285-286.
- Nomikou E, Tsevrenis V, Gafou A, et al. Type IIb von Willebrand disease with angiodysplasias and refractory gastrointestinal bleeding successfully treated with thalidomide. Haemophilia 2009; 15: 1340-1342.
- Franchini M, Mannucci PM.Gastrointestinal angiodysplasia and bleeding in von Willebrand disease. Thromb Haemost 2014;112:427-431
- Heidt J, Langers AM, Van Der Meer FJ,Brouwer RE. Thalidomide as tretment for digestive tract angiodyspasias. Neth J Med 2006;17:182-185
- Kamalaporn P,Saravanan R,CiroccoM, et al. Thalidomide for the tretment of chronic gastrointestinal bleeding from angiodysplasias: a case series. Eur J Gastroenterol Hepatol. 2009;21:1347-1350
- Morris ES, Hampton KK, Nesbitt IM, et al. The management of von Willebrand’s disease associated gastrointestinal dysplasia. Blood Coagul Fibrinolysis 2001; 12: 143–148.
- Lenting PJ, Casari C, Christophe OD, Denis CV. Von Willebrand factor: the old, the new and the unknown. J Thromb Haemost. 2012; 10:2428-2437
- V. Khatrit, I B. Patel, C. M. Kesslert, D. R. Kohli, S. S. Solomon K. Bull-Henryt ,CM Kessler, Lenalidomide as a novel therapy for gastrointestinal angiodysplasia in von Willebrand disease Haemophlia. 2018;24:278-282



