Il deficit congenito di fibrinogeno (CFD) è una malattia rara con una incidenza nella popolazione generale di 1 o 2 soggetti per milione.
Normalmente si distingue l’afibrinogenemia (completa assenza di fibrinogeno) dalla ipofibrinogenemia (diminuzione proporzionale più o meno importante di livelli di fibrinogeno funzionale e antigenico). La carenza di fibrinogeno può portare a una formazione insufficiente di coaguli di fibrina con conseguente eccessivo sanguinamento anche in presenza di lesioni tissutali minori o a seguito anche di episodi emorragici spontanei di varia gravità.
Storicamente, il trattamento CFD è consistito nella somministrazione di crioprecipitato o plasma fresco congelato (FFP) tuttavia entrambi hanno notevoli limitazioni in quanto non sono in grado di assicurare livelli standard e certificati di fibrinogeno ed inoltre possono contenere molte altre proteine plasmatiche.
I concentrati di Fibrinogeno /(HCF), virus inattivati, con livelli certificati di proteina rappresentano lo standard attuale nella terapia dei deficit di fibrinogeno congeniti. Di essi è dimostrata l’efficacia insieme ai profili di sicurezza negli adulti e negli adolescenti.
Qui riportiamo in sintesi i dati di uno studio di C.D.Khayat et.al. (Haemophili
2121;27:283-292) di Fase 3 denominato FORMA-04 (NCT02408484) multinazionale, multicentrico, prospettico in pazienti pediatrici con il fine di valutare l’efficacia, la sicurezza, la farmacocinetica mediante una monodose dell’HFC (Fibryga®, Octapharma AG) per il trattamento a domanda di sanguinamenti spontanei o post traumatici e per la profilassi chirurgica.
Dei 14 pazienti trattati con HFC (età mediana [intervallo] 6,0 anni [1,0–10,0]), otto hanno ricevuto HFC per 10 BE, tre per la profilassi chirurgica e 13 per PK.
Tutti i pazienti avevano meno di 12 anni all’inizio dello studio e tutti con afibrinogenemia.
I dati sono stati analizzati per l’intera popolazione di pazienti pediatrici in studio, nonché per due sottogruppi di età (<6 anni e ≥6–<12 anni) (Tavola 1).
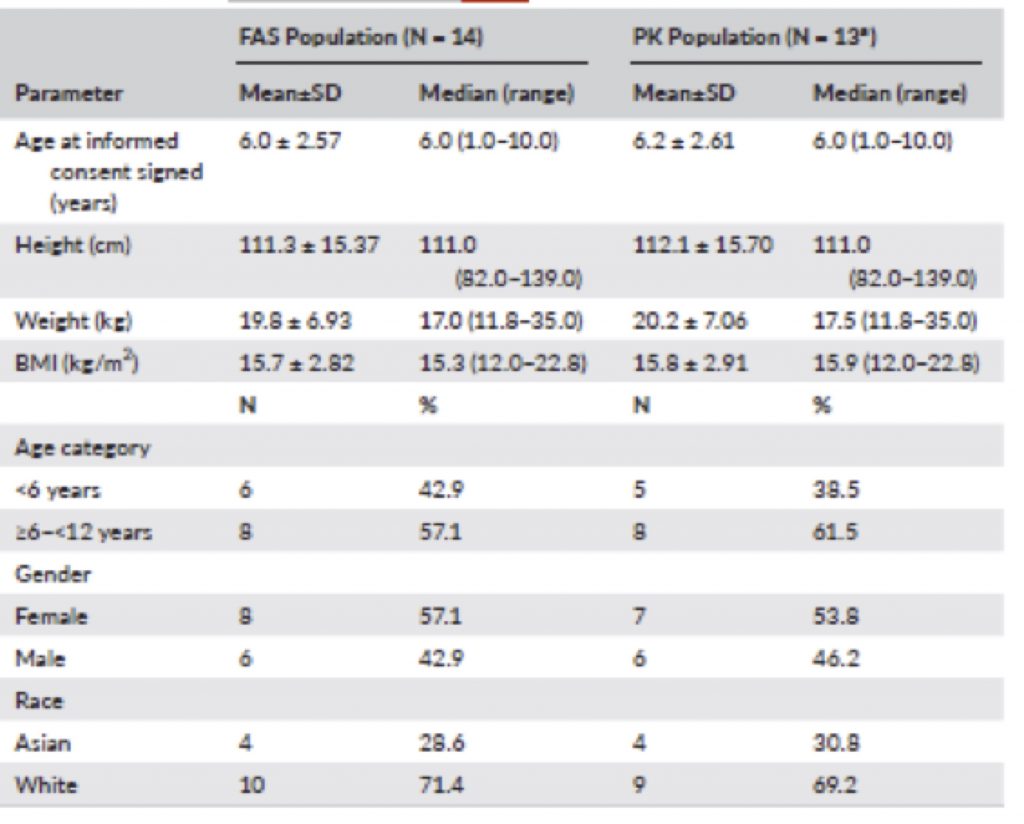
Tavola 1 Caratteristiche della popolazione arruolata nello studio osservazionale ed in quello della farmacocinetica (FAS soggetti arruolati e studiati – PK studio della farmacocinetica)
I parametri presi in considerazione sono stati a) efficacia emostatica valutata da un comitato indipendente usando una scala su 4 punti (IDMEAC) b) il recupero in vivo (IVR) c) valutazione della qualità del coagulo (MCF surrogato dell’efficacia emostatica) d) la valutazione del PK e) la sicurezza
L’efficacia emostatica si è dimostrata eccellente (IDMEAC), in entrambi i sottogruppi di età, in tutti i dieci casi di sanguinamento spontaneo e post-traumatico.
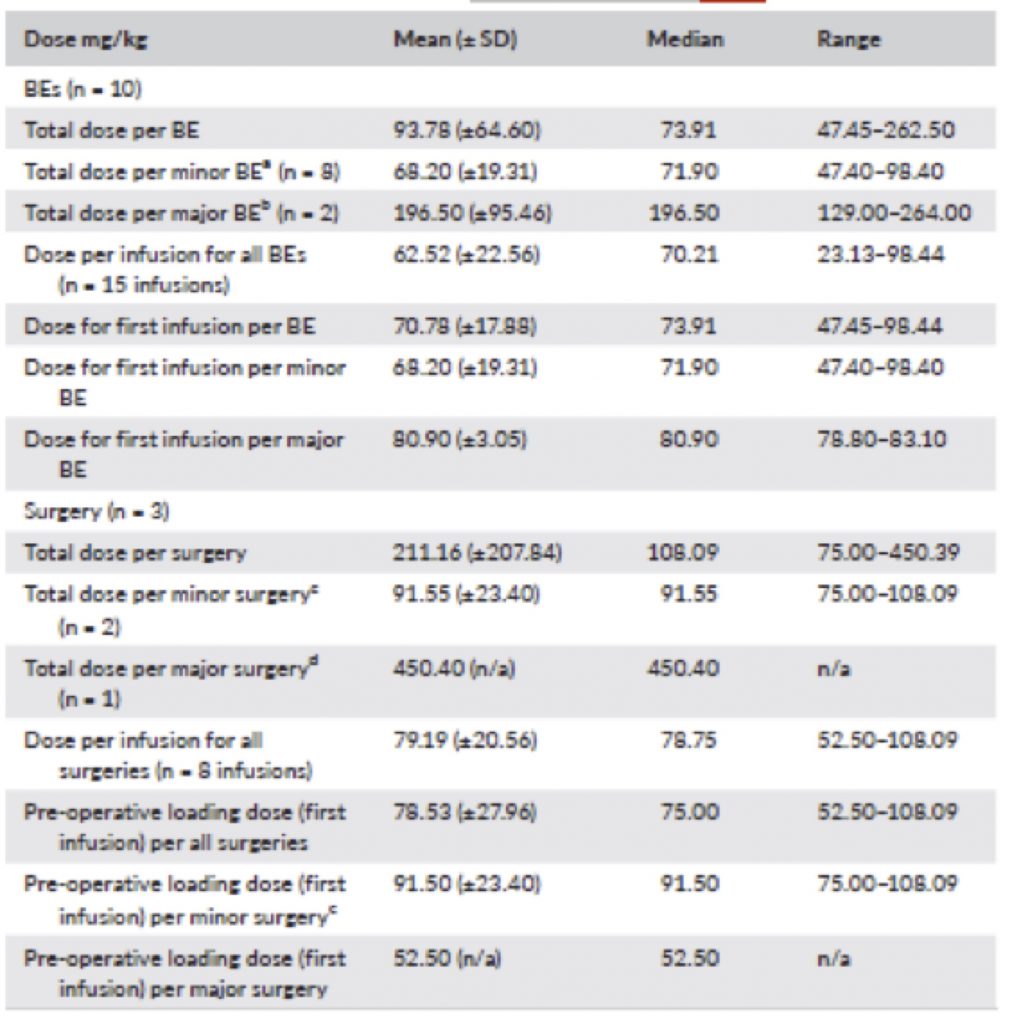
Tavola 2
Dosaggi HCF per il trattamento a domanda (BE) e in regime di profilassi chirurgica. a- sanguinamenti minori un solo trattamento b-sanguinamenti maggiori quattro trattamenti c-chirurgia minore nessun trattamento nel post operatorio d-chirurgia maggiore sei trattamenti
L’IVR, in questo gruppo, calcolato alla terza ora post-infusione è stato nel suo complesso di 1,5 mg/dl. Tre gli interventi chirurgici di cui uno maggiore (splenectomia). In quest’ultimo caso sono state praticate sei infusioni. Controllo emostatico eccellente in tutti i casi chirurgici ed un IVR medio di 1.3 mg/dl.
Nella popolazione emorragica, il livello plasmatico basale del fibrinogeno, dopo la prima infusione di HFC, è aumentato in tutti i pazienti: dopo 1 ora il livello medio di fibrinogeno (±DS) era 98,1 mg/dL (±13,33), con una mediana (intervallo) di 100,0 mg/dL (79,0–118,0).
Per la valutazione del MCF è stato utilizzato il ROTEM e misurato immediatamente prima (< 30min) e ad 1 ora post–infusione alla prima infusione.
Alla prima dose di HFC (dose media ±SD) pari a 70,78 mg/kg (±17,19) si è verificato un aumento significativo della MCF. Si è passati da un valore di base pari (0,0 mm), ad un aumento medio di 3,3 mm (±1,77) e ad una variazione mediana (intervallo) di 4,0 mm (0,0–5,0; P = 0,0002) a 1 ora post-infusione, con comportamenti identici tra i sottogruppi di età (Tavola 2). L’aumento complessivo statisticamente significativo di MCF rispetto al basale ha coinciso con l’efficacia emostatica nel sanguinamento popolazione, come giudicato dall’IDMEAC.
Per lo studio della farmacocinetica sono stati chiesti ai pazienti 14 giorni di wash-out per qualsiasi prodotto a contenuto di fibrinogeno. I campioni sono stati prelevati prima dell’infusione di HFC e a 1 e 3 ore e nei giorni post-infusione 2, 5, 7, 10 e 14.
La farmacocinetica è stata studiata in tredici pazienti con una singola infusione di HFC con una dose effettiva di 73,5 mg/kg. In tutti i soggetti, prima della somministrazione di HFC, il livello plasmatico del fibrinogeno era al/al di sotto del limite di rilevazione dei sistemi diagnostici con metodo Clauss.
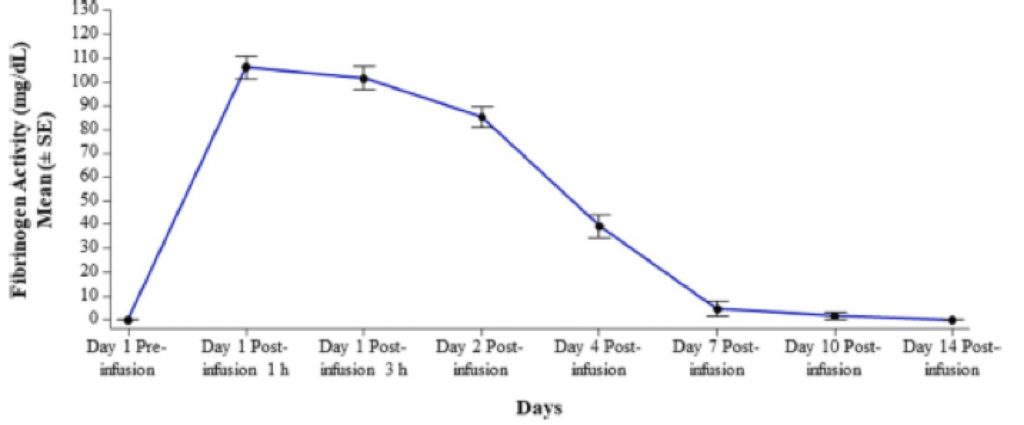
Fig.2
Valori di attività del fibrinogeno (g/L) durante lo studio di farmacocinetica con HFC (13 soggetti ). I livelli inferiori a <30 mg/dL (limite discriminante dei test) sono stati considerati pari a zero.
Il fibrinogeno ha mostrato poi comportamenti caratterizzati da aumenti con valori in media di 106,1 mg/dL (±17,04) dopo 1 ora dall’infusione e di 101,5 mg/dL (±17,36) a 3 ore dopo l’infusione. Il livello plasmatico di fibrinogeno scende poi mediamente a valori di riferimento pre-trattamento dopo circa 7 giorni (Figura 2). I Parametri del PK sono presentati nella Tabella 5 ed erano comparabili tra i sottogruppi di età.
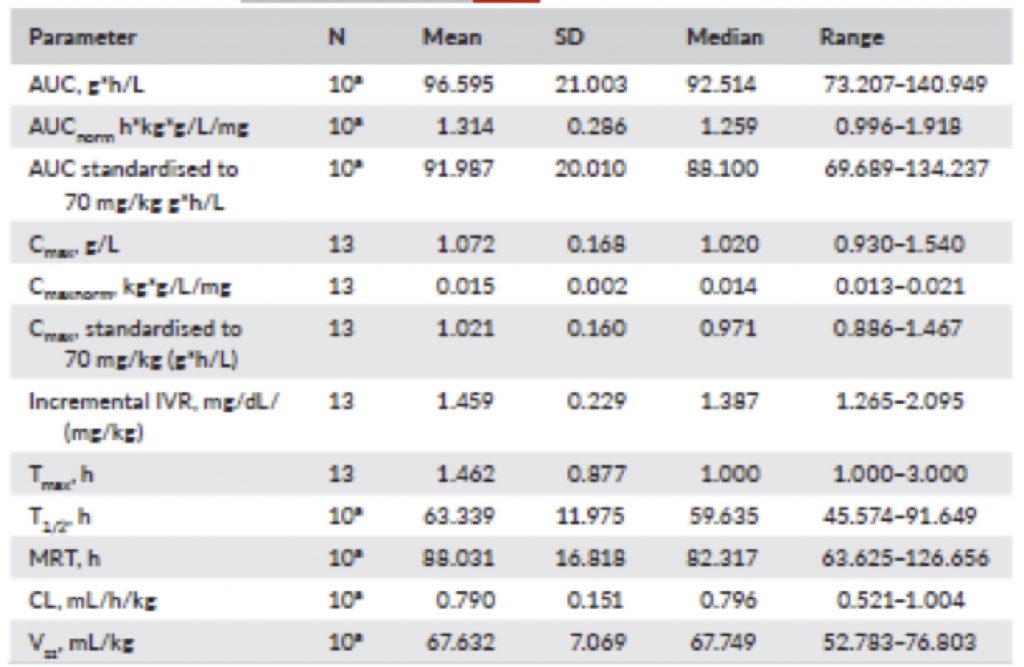
TABLE 5 PK parameters for HFC determined by fibrinogen activity (PK population, N = 13) AUC,area sotto la curva – Cmax massima concentrazione plasmatica – Cmaxnorm normalizzata alla dose somministrata – CL clearance – HFC fibrinogeno concentrato – IVR recupero in vivo
Questo studio conferma sicuramente l’efficacia del HFC nel trattamento di BE e nella profilassi peri-operatoria, dimostrando nel contempo aumenti significativi dei livelli plasmatici del fibrinogeno e di altri marcatori dell’emostasi.
Tuttavia un limite di questa esperienza è rappresentata dal numero limitato di pazienti studiati in questa fascia di età. Inoltre, il limitato numero di BE maggiori e degli interventi chirurgici rappresenta una limite per l’identificazione del corretto dosaggio e per la valutazione della risposta emostatica negli episodi più gravi. Dobbiamo sottolineare, tuttavia, che quest’ultima condizione riflette la variabilità e l’impostazione degli studi su patologie ultra-rare come il CFD.
Infine, a conforto, si sottolinea che questi dati di efficacia, insieme a quelli della sicurezza, sono coerenti con gli studi già pubblicati e riferiti ad una popolazione adulta e di adolescenti.
Letture
- Casini A, Undas A, Palla R, et al. Diagnosis and classification of con Genital fibrinogen disorders: communication from the SSC of the ISTH. J Thromb Haemost. 2018;16(9):1887-1890.
- Peyvandi F, Haertel S, Knaub S, Mannucci PM. Incidence of bleeding symptoms in 100 patients with inherited afibrinogenemia or hypofibrinogenemia. J Thromb and Haemost. 2006;4(7):1634-1637
- Sørensen B, Bevan D. A critical evaluation of cryoprecipitate for replacement of fibrinogen. Br J Haematol. 2010;149(6):834-843.
- Bellon A, Fuseau E, Roumanie O, et al. Population pharmacokinetics of a triple-secured fibrinogen concentrate administered to afibrino genaemic patients: Observed age- and body weight-related differences and consequences for dose adjustment in children. Br J Clin Pharmacol. 2020;86(2):329-337.
- Manco-Johnson MJ, Dimichele D, Castaman G, et al. Pharmacokinetics and safety of fibrinogen concentrate. J Thromb Haemost. 2009;7(12):2064-2069.
- Franchini M, Lippi G. Fibrinogen replacement therapy: a critical review of the literature. Blood Transfus. 2012;10(1):23-27.