I risultati del trial BIVOO1 di fase 1/2 sono stati pubblicati da B.A.Konkle et al. su NEJM di settembre 2020 accompagnati da un interessante commento di PM Mannucci. Il BIVV001 è un nuovo fattore VIII ricombinante sviluppato con l’obiettivo di un solo trattamento settimanale per la prevenzione di episodi emorragici in pazienti con emofilia A. Il BIVV001 è la prima terapia sperimentale con fattore VIII indipendente dal fattore von Willebrand.
L’emivita dei FVIII ricombinanti di ultima generazione attualmente in commercio presentano una half-life con un range che va dalle 15 a 19 ore e questo limite è dovuto all’azione del fattore di von Willebrand che svolge il ruolo di “chaperone”.
Ricordiamo che il fattore VIII interagisce in modo non covalente con il fattore von Willebrand endogeno (VWF) con l’importante compito di stabilizzare e proteggere il fattore VIII dalle proteasi. Il VWF, quindi, agisce essenzialmente come un accompagnatore (chaperone) ma nello stesso tempo ne condiziona e ne limita l’emivita. Le tecniche di peghilazione e fusione Fc hanno aumentato l’emivita del fattore VIII a solo 1,5 a 2 volte rispetto al fattore VIII standard proprio per l’effetto limitante del VWF. Quindi, la sfida per aumentare ulteriormente l’emivita del fattore VIII, secondo B.A.Konkle et al., si gioca sullo sviluppo di una nuova classe di fattore VIII capace di disaccoppiarsi dal VWF endogeno.

Fig. A – Struttura della proteina di fusione BIVV001(rFVIIIFc-VWF-XTEN), progettata per separare il fattore VIII ricombinante (rFVIII) dal fattore von Willebrand (VWF) in circolazione. BIVV001 è costituito da una singola molecola di rFVIII fusa con Fc dimerico, un dominio D′D3 di VWF (dominio di legame del fattore VIII) e due polipeptidi XTEN per aumentare l’emivita dell’attività del fattore VIII. Sono annotati i domini proteici del fattore VIII (A1, A2, A3, C1 e C2) e VWF (D′D3); a1, a2 e a3 (regioni acide [cerchi azzurri]) rappresentano i siti naturali di scissione della trombina del fattore VIII.
Il BIVV001 è ingegnerizzato con tecnologia che, ad un F.VIII ricombinante con tecnica di fusione Fc, aggiunge un dominio (D’D3) in grado di disaccopiare il FVIII dal fattore von Willebrand e due polipeptidi XTEN in grado di prolungarene l’emivita.
Il legame covalente del domino D’D3 al FVIII ricombinante previene il legame del vWF endogeno ma ne mantiene ancora le caratteristiche stabilizzanti(Figura A).
L’emivita del fattore ricombinante VIII è poi ulteriormente potenziato dalla fusione al dominio Fc dell’immunoglobulina G1 (IgG1) e dai due polipeptidi XTEN.
Studi preclinici in primati hanno ben documentato che il l’uso di BIVV001 determina un’emivita del fattore VIII da tre a quattro volte più lungo (sino a 34 ore) rispetto a quello ottenibile con il solo ricombinante.
Sempre in esperienze precliniche, condotte in animali emofilici, è stata confermata la capacità emostatica del BIVOO1 e la non interferenza con la funzione piastrinica.
Lo studio aperto di fase 1 / 2 di B.A.Konkle et al., è stato condotto con l’intento di documentare i risultati di una singola dose di BIVV001 avendo come obiettivo primario la sicurezza intesa come possibilità di eventi avversi, come sviluppo di inibitori e come cambiamenti nell’attività del vWF (misurato come cofattore della Ristocetina). Obiettivo secondario era ovviamente quello di caratterizzare la farmacocinetica del BIVOO1 paragonata ad un fattore VIII umano full-lenght-rFVIII attualmente in commercio.
Lo studio è stato condotto in sei centri per l’emofilia distribuiti in Giappone e negli Stati Uniti. Sedici i pazienti arruolati di età compresa tra i 18 ed i 65 anni con emofilia grave e con una storia di almeno 150 trattamenti con il FVIII. I criteri di esclusione ovviamente erano rappresentati da un’attività misurabile di inibitore con metodo Bethesda modificato e da un livello plasmatico di cofattore della Ristocetina meno di 50 IU per decilitro.
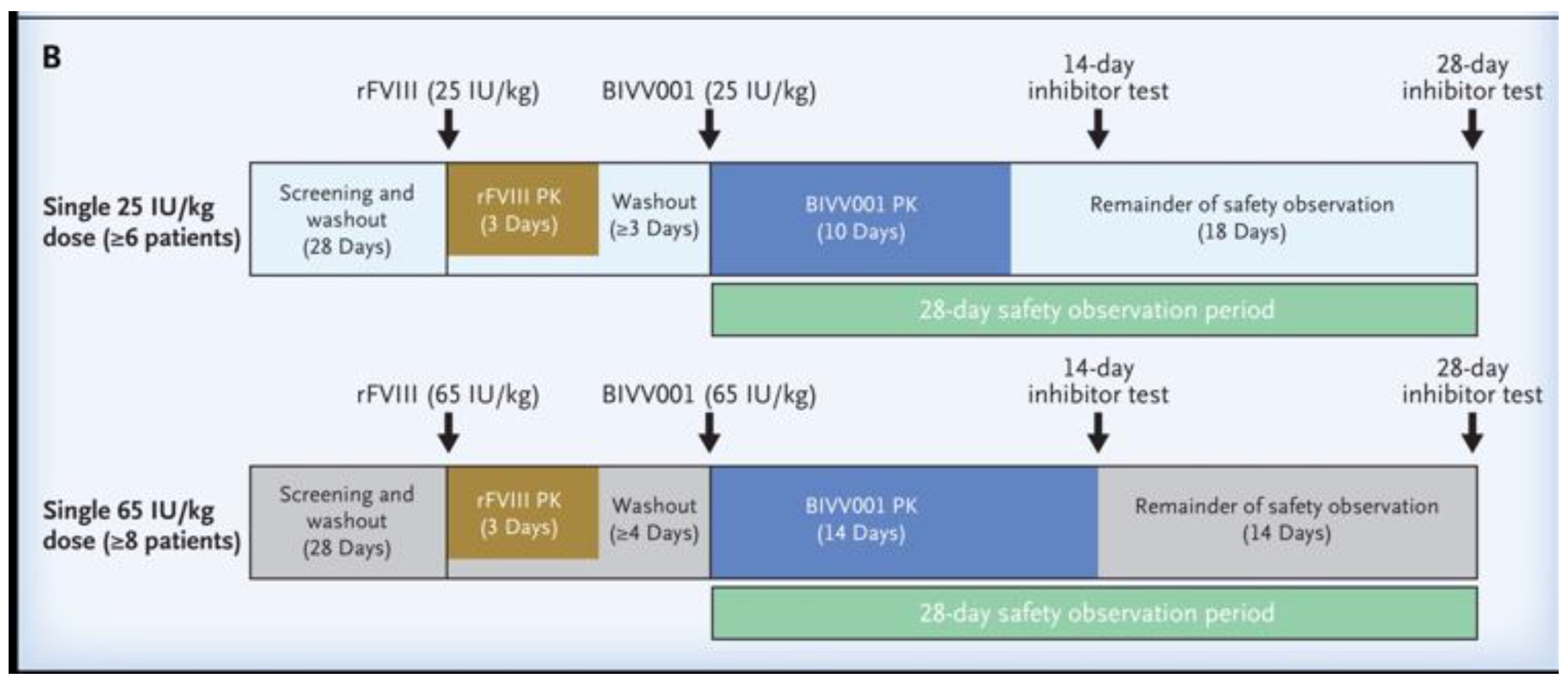
Lo schema dello studio ha previsto di dividere i pazienti in due gruppi che hanno ricevuto 25 UI o 65 UI per Kg p.c. di fattore VIII ricombinante full-lenght. Quindi è seguito un periodo di almeno 3 giorni di washout. A seguire i soggetti arruolati, suddivisi negli stessi gruppi, hanno poi ricevuto un nuovo singolo trattamento con BIVV001 sempre con il dosaggio di 25 UI o 65 UI per Kg p.c di ( Figura B).
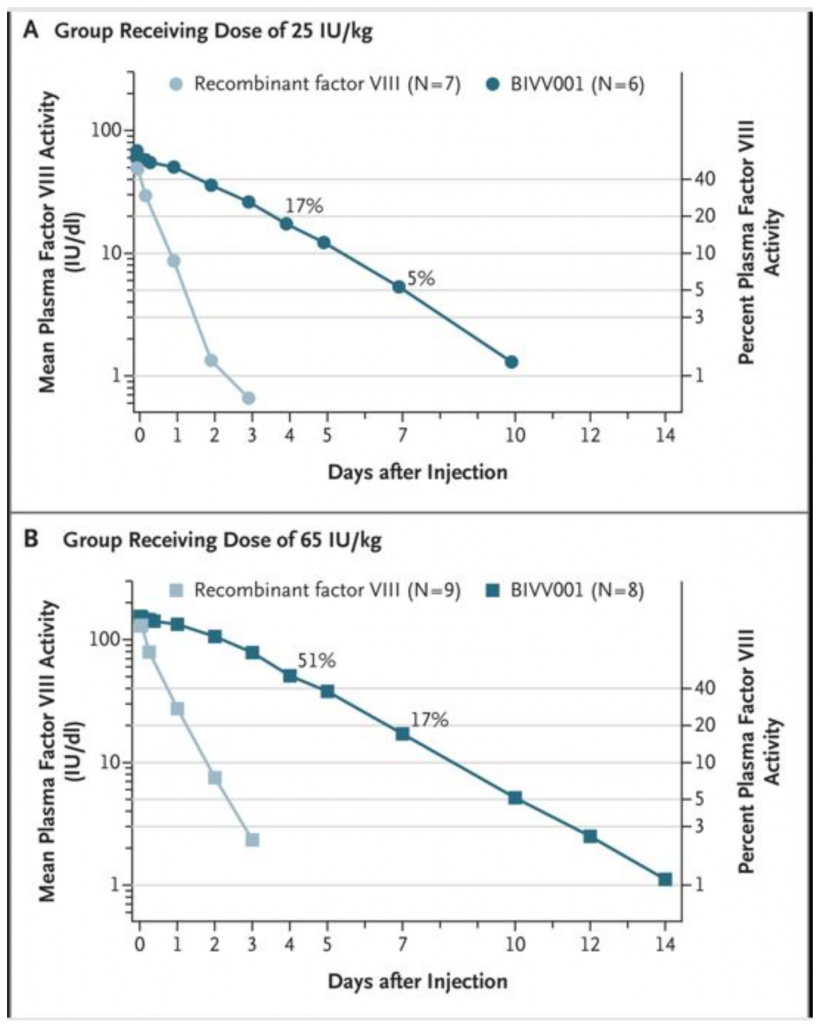
Fig. C – Livelli di attività del FVIII in 14° giornata nei due gruppi. Nota nel quadro B è da segnalare che un paziente prima di ricevere BIVVOOI è uscito dallo studio a causa di un incidente automobilistico.
I pazienti sono stati attentamente controllati sino al 28° giorno dopo l’infusione di BIVVOO1. Non sono stati rilevati inibitori del fattore VIII e non sono stati segnalati episodi di ipersensibilità o anafilassi. L’emivita media geometrica di BIVV001 è stata da tre a quattro volte più lunga di quella del rFVIII full lenght (37,6 ore contro 9,1 ore nel gruppo a dose più bassa e 42,5 ore contro 13,2 ore nel gruppo a dose più alta). L’area sotto la curva (AUC) del BIVVOO1 è stata da sei a sette volte maggiore nei due gruppi di dosaggio (4470 ore vs.638 ore × UI per decilitro nel gruppo a dose più bassa e 12.800 ore rispetto a 1960 ore UI per decilitro nel gruppo a dose più alta)
La somministrazione di BIVV001 alla dose di 65 UI/Kg p.c. ha determinato un livello medio di fattore VIII al 4° giorno ≥51% e di 17% in settima giornata. Questi dati hanno permesso agli autori di ritenere possibile un trattamento profilattico con intervallo settimanale (Figura C).
Gli autori concludono che il BIVVOO1 non ha mostrato, all’infusione di una singola dose, nessun problema relativo alla sicurezza del prodotto. Gli elevati livelli di FVIII registrati in 14° giornata da una singola dose di BIVV001 aprono la possibilità di una profilassi efficace praticata con intervalli più lunghi.
PDF: B.A.Konkle et al.et al BIVV001 Fusion Protein as Factor VIII Replacement Therapy for Hemophilia A . N Engl J Med 2020:383: 1018-277.
Per Approfondire:
- Pipe SW, Montgomery RR, Pratt KP et al. Life in the shadow of a dominant partner: the FVIII-VWF association and its clinical implications for hemophilia A. Blood 2016; 128: 2007-16.
- Tiede A, Brand B, Fischer R, et al. Enhancing the pharmacokinetic properties of recombinant factor VIII: first-in-human trial of glycoPEGylated recombinant factor VIII in patients with hemophilia A. J Thromb Haemost 2013; 11: 670-8.
- Coyle TE, Reding MT, Lin JC et al. Phase I study of BAY94-9027, a PEGylated B-domain-deleted recombinant factor VIII with an extended half-life, in subjects with hemophilia A. J Thromb Haemost 2014; 12: 488-96.
- Seth Chhabra E, Liu T, Kulman J, et al. BIVV001, a new class of factor VIII replacement for hemophilia A that is independent of von Willebrand factor in primates and mice. Blood 2020; 135: 1484-96.
- Peters RT, Toby G, Lu Q, et al. Biochemical and functional characterization of a recombinant monomeric factor VIIIFc fusion protein. J Thromb Haemost 2013; 11: 132-41.
- Podust VN, Balan S, Sim B-C, et al. Extension of in vivo half-life of biologically active molecules by XTEN protein polymers. J Control Release 2016; 240: 52-66.
- Liu T, Chhabra ES, Moore N, et al. The pharmacokinetic profiles of intravenously and subcutaneously administered recombinant FVIIIFc-VWF-XTEN in cynomolgus monkey. Haemophilia 2016; 22: Suppl 4: 17. abstract.
- Nogami K, Shima M, Fukutake K, et al. Efficacy and safety of full-length pegylated recombinant factor VIII with extended half-life in previously treated patients with hemophilia A: comparison of data between the general and Japanese study populations. Int J Hematol 2017; 106: 704-10.
- Berntorp E, Negrier C, Gozzi P et al. Dosing regimens, FVIII levels and estimated haemostatic protection with special focus on rFVIIIFc. Haemophilia 2016; 22: 389-96.
- Ekta Seth Chhabra, Tongyao Liu, John Kulman et al. BIVV001, a new class of factor VIII replacement for hemophilia A that is independent of von Willebrand factor in primates and mice Blood 2020;135 ( 17 ) 1484-1496