Studio multicentrico in emofilici gravi senza inibitore con meno di 12 anni. Valutata l’efficacia, la sicurezza e la farmacocinetica.
L’emicizumab è un anticorpo monoclonale bispecifico umanizzato ricombinante che mima la funzione di cofattore del FVIII.
Lo studio Haven 1 e Haven 3 ha dimostrato che l’emicizumab è clinicamente efficace nella prevenzione dei sanguinamenti in pazienti adulti e adolescenti con o senza inibitori con una dose sottocutanea di 1,5 mg / kg alla settimana.
HAVEN 3 e Haven 4 hanno poi dimostrato la medesima efficacia con dosi sottocutanee di 3 mg / kg ogni 2 settimane (Q2W) e di 6 mg / kg ogni 4 settimane.
In fine Haven 2 ha confermato anche nei pazienti pediatrici con inibitore l’efficacia dell’emicizumab.
Tuttavia mancava una esperienza clinica nei piccoli pazienti senza inibitore; lacuna colmata appunto con questo studio denominato HOHOMI ( Shima M, Nogami K, Nagami S, et al. A multicentre, open‐label study of emicizumab given every 2 or 4 weeks in children with severe haemophilia A without inhibitors. Haemophilia. 2019;25:979–987).
HOHOMI è stato condotto in Giappone in quattro differenti strutture arruolando pazienti senza inibitori, di età pari o superiore a 3 anni, con un peso superiore ai 3 kg e comunque con meno di 12 anni.
Tab 1
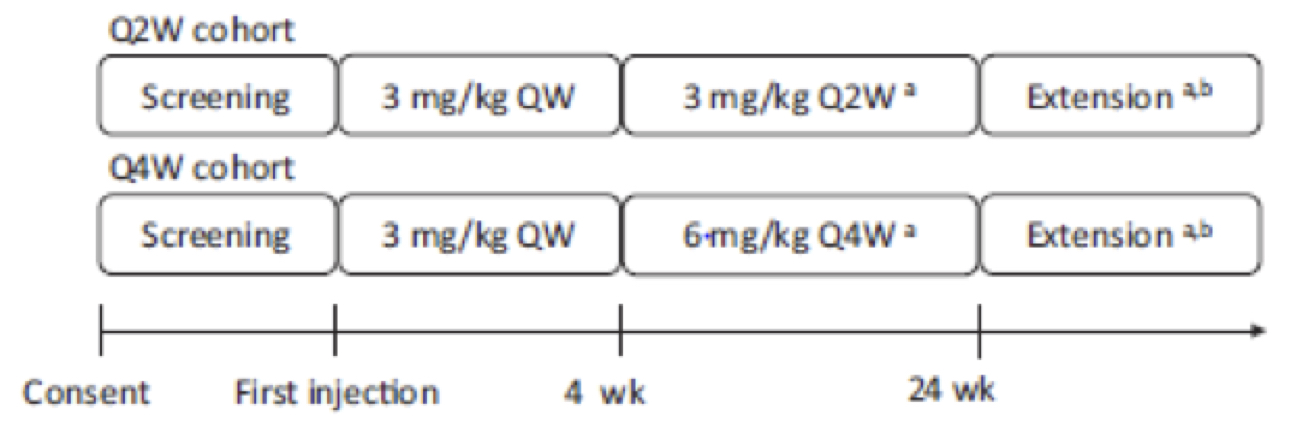
Questo studio multicentrico, in aperto, non randomizzato è stato progettato per valutare l’efficacia, la sicurezza e la farmacocinetica di emicizumab somministrato per via sottocutanea alla dose di mantenimento di 3 mg / kg ogni due settimane (Q2W) o 6 mg / kg ogni quattro settimane (Q4W) in pazienti pediatrici con emofilia A senza inibitori. Entrambe le coorti Q2W e Q4W hanno ricevuto una dose di carico di 3 mg / kg settimana (QW) per via sottocutanea per le prime 4 settimane prima del dosaggio di mantenimento (Figura 1).
Fig.1 Q2W, ogni 2 settimane; Q4W,ogni 4 settimane.
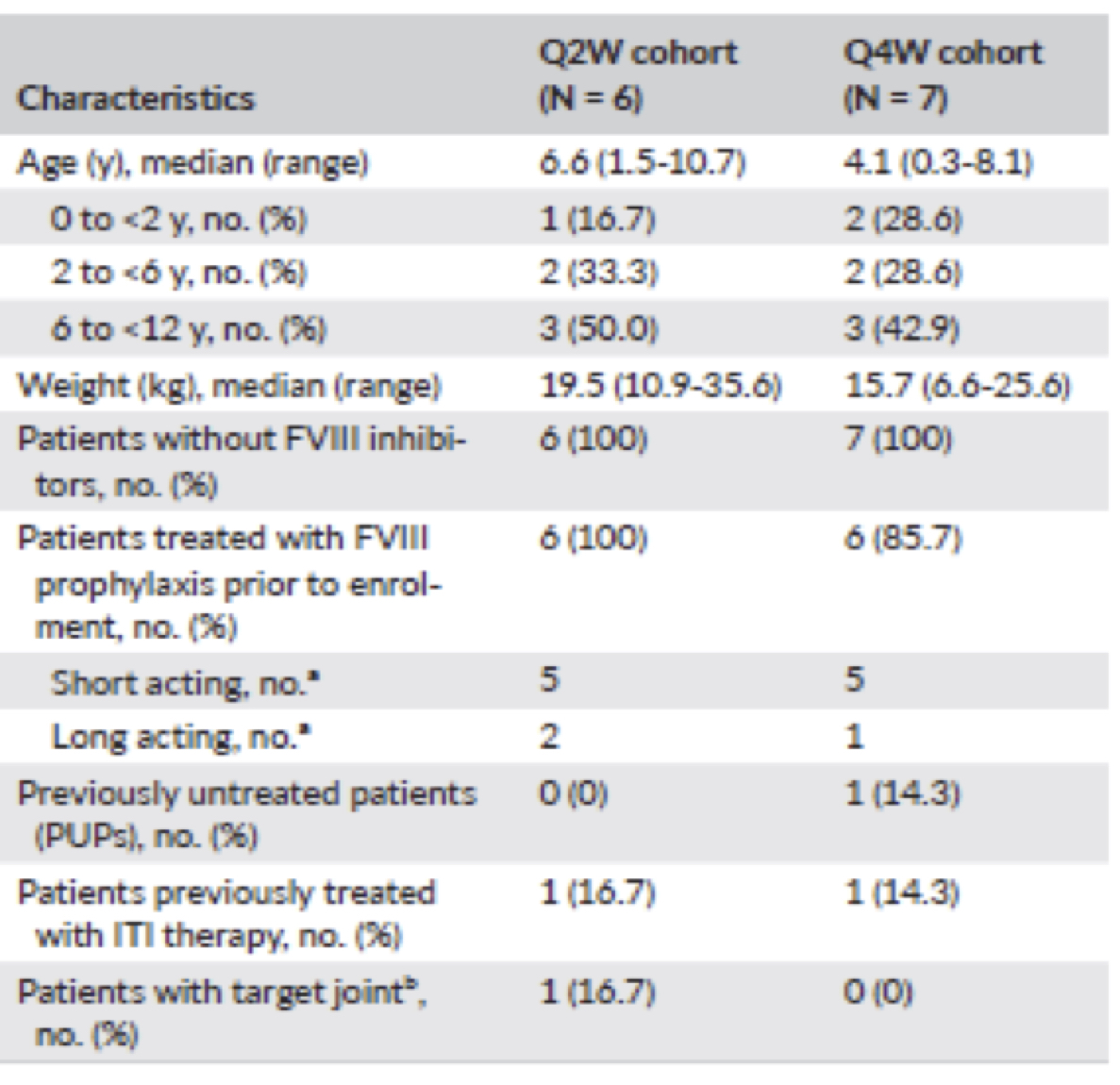
In totale in questa esperienza sono stati arruolati 13 piccoli pazienti senza inibitori che hanno regolarmente completato come da programma almeno 24 settimane di trattamento. Sei pazienti sono stati inseriti nel gruppo Q2W e 7 in quello Q4W (tab 1).
L’età all’arruolamento andava da 4 mesi a 10 anni. Tutti i pazienti erano in regime di profilassi con fattore VIII prima di essere arruolati, tranne il paziente di 4 mesi di età (PUP) inserito nel gruppo Q4W.
Ogni coorte ha compreso un paziente che in precedenza era stato sottoposto con successo alla ITI (in un periodo che andava da 7,4 in un caso e nell’altro di 0,4 anni prima dell’arruolamento). Un solo un paziente inserito nel gruppo Q2W aveva un’articolazione target.
Al momento della raccolta ed analisi dei dati tutti i 13 pazienti erano correttamente in trattamento con emicizumab e nessuno aveva avuto necessità di modificare il dosaggio nel corso dello studio.
La durata mediana (intervallo) del trattamento è stata rispettivamente di 39,1 (36,4-40,3) settimane e 32,1 (24,1-36,4) settimane nelle coorti Q2W e Q4W,
E’ stato osservato un solo un evento avverso, di scarsa importanza (una reazione al sito di iniezione). Non si sono verificati eventi tromboembolici o quadri di microangiopatia trombotica. Nessun paziente ha mostrato comparsa di anticorpi anti – emicizumab.
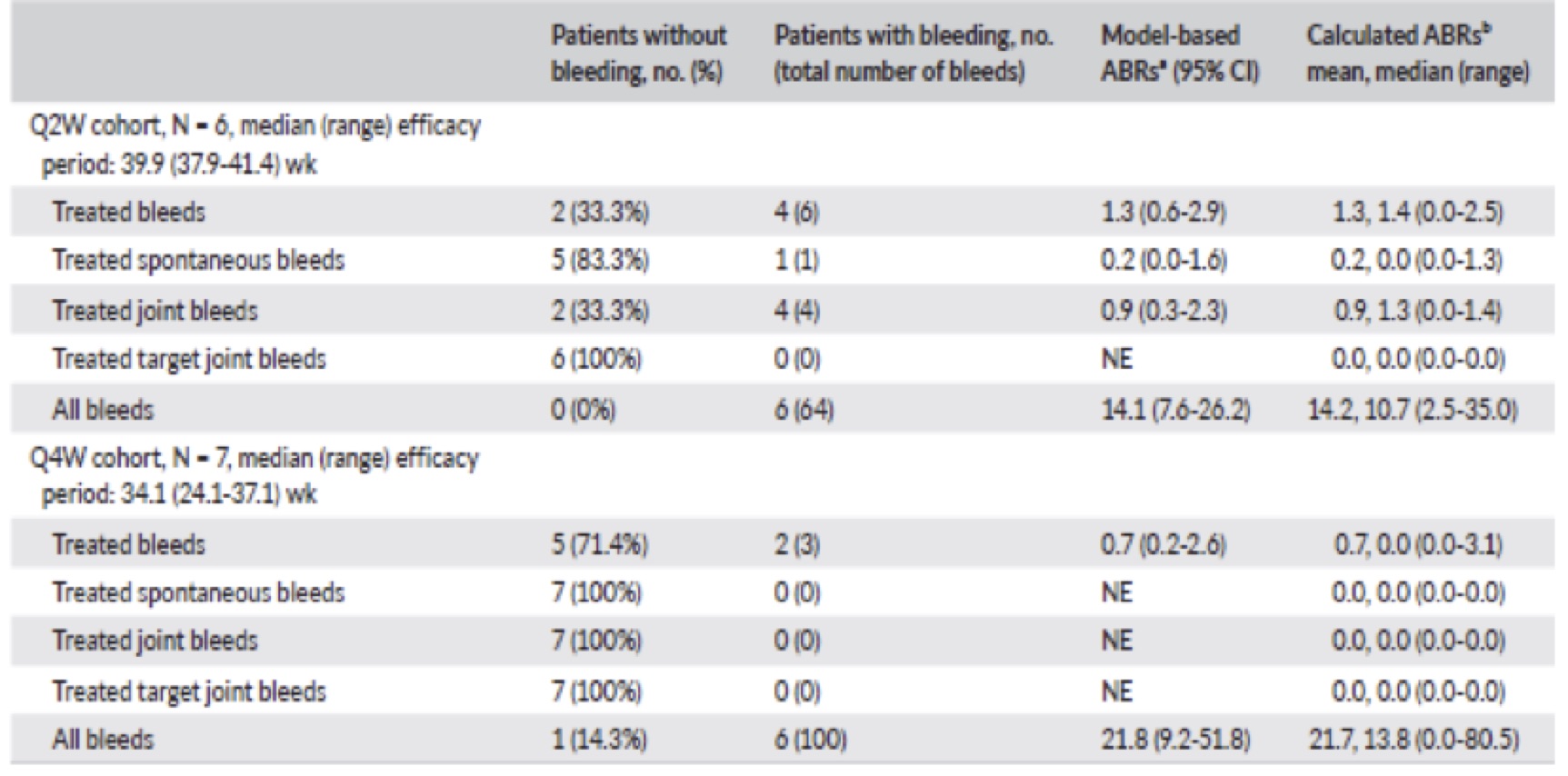
Nessun sanguinamento si è registrato, durante il periodo di osservazione, in 2 dei 6 pazienti del gruppo Q2W e in 5 di 7 pazienti, incluso il PUP, 7 nel gruppo Q4W.
Sempre nel periodo di osservazione sono stati osservati 4 sanguinamenti in 4 pazienti nel gruppo Q2W: un sanguinamento articolare spontaneo e altri di origine traumatica. Nel Q4W si sono verificati 3 sanguinamenti post traumatici.
Tutti i sanguinamenti traumatici sono stati gestiti con una singola dose di FVIII (32,5-64,7 UI / kg); il solo evento spontaneo si è verificato in un’articolazione ed è stato gestito con FVIII somministrato una volta al giorno per 5 giorni (31,4-32,6 UI / kg).
L’ABR calcolato sulla base degli eventi emorragici nello studio sono stati bassi in entrambi i gruppi senza chiare differenze tra Q2W e Q4W (1,3 [95% CI, 0,6-2,9] e
0,7 [95% CI, 0,2-2,6], rispettivamente) (Tab.2).
È importante sottolineare che questi ABR sono paragonabili a quelli di pazienti adulti e adolescenti negli stessi regimi terapeuti Q2W o Q4W negli studi HAVEN 3 e HAVEN 4; 1,3 (IC 95%, 0,8-2,3) per il regime Q2W e 2,4 (95% CI, 1.4‐4.3) per il regime Q4W.
Questo studio dimostra efficacia e sicurezza dell’emicizumab ai regimi Q2W e Q4W nei bambini con emofilia grave A senza inibitori, compreso un PUP di 4 mesi.
Tab.2
L’esposizione all’ emicizumab di questi pazienti ha presentato un quadro di variabilità che rientra in quella osservata nei precedenti studi su adulti / adolescenti.
Questi risultati confermano dunque la possibilità di applicare i regimi terapeutici Q2W e Q4W regimi in pazienti pediatrici con emofilia A senza inibitori.
I principali limiti di questo lavoro sono rappresentati dalla sua struttura in aperto non randomizzato e dal piccolo numero di pazienti che rendono difficile ottenere solidi risultati per la valutazione di efficacia e sicurezza.
Riferimenti
- Oldenburg J, Mahlangu JN, Kim B, et al. Emicizumab prophylaxis in hemophilia A with inhibitors. N Engl J Med. 2017;377:809‐818.
- Mahlangu J, Oldenburg J, Paz‐Priel I, et al. Emicizumab prophylaxis in patients who have hemophilia A without inhibitors. N Engl J Med. 2018;379:811‐822.
- Pipe SW, Shima M, Lehle M, et al. Efficacy, safety, and pharmacokinetics of emicizumab prophylaxis given every 4 weeks in people with haemophilia A (HAVEN 4): a multicentre, open‐label, non‐randomised phase 3 study. Lancet Haematol. 2019;6(6):e295‐e305.
- Young G, Liesner R, Sidonio RF Jr, et al. Emicizumab prophylaxis provides flexible and effective bleed control in children with hemophilia Α with inhibitors: results from the HAVEN 2 study. Blood. 2018;132(Suppl 1):632.
- Paz‐Priel I, Chang T, Asikanius E, et al. Immunogenicity of emicizumab in people with hemophilia A (PwHA): results from the HAVEN 1–4 studies. Blood. 2018;132(Suppl 1):633.