La profilassi con il fattore VIII (FVIII), concorde tutto il mondo scientifico, è il trattamento standard per i pazienti con emofilia A grave (FVIII <1%) ed è fondamentale nel ridurre i rischi dei sanguinamenti spontanei e, in definitiva, nel prevenire lo sviluppo di artropatia cronica .
La profilassi ovviamente richiede un protocollo di frequenti trattamenti endovenosi che può incidere negativamente sulla aderenza al programma terapeutico. L’introduzione nella farmacopea dei fattori con una prolungata emivita (EHL) ha permesso di agevolare notevolmente l’aderenza alla corretta profilassi degli emofilici.
Il livello minimo di FVIII sufficiente a prevenire i sanguinamenti nei singoli soggetti varia in funzione di numerosi fattori quali la farmacocinetica PK, il fenotipo emorragico et ec. Tuttavia l’allungamento del tempo di persistenza dei livelli minimi di FVIII è considerato uno dei più importanti indici prognostici per il controllo dei sanguinamenti in corso di profilassi.
Fig.1 – Il rFVIII B-deleto Peghilato (EHL) – Bay 94-90027 (JIVI)
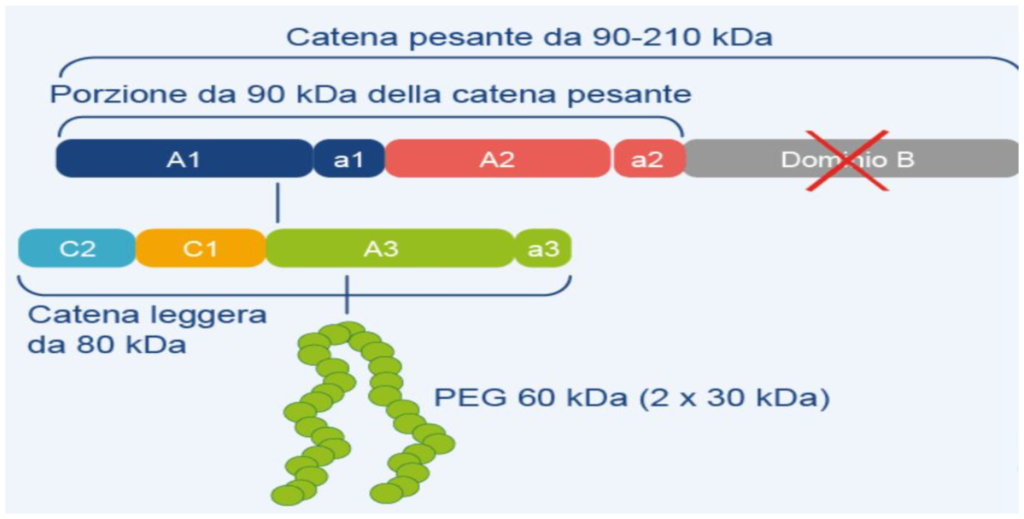
Gli EHL con la loro migliore Farmacocinetica (Pk) rispetto al FVIII standard hanno la prerogativa di mantenere livelli accettabili di fattore per un periodo tre volte più lungo. Anche in questo caso i parametri quali il recupero, l’half life, l’area sotto la curva e la clearance sono considerati elementi importanti per valutare “la bontà “dei nuovi EHL. In uno studio comparso recentemente su Annals of Hematology A. Shah e coll. hanno valutato il comportameno di due EHL, un rFVIII B-deleto e Peghilato [ BAY 94-9027 – Jivi – BAYER] (Fig.1) e un rFVIII FC (Elocta- SOBI). Sia Jivi che Elocta in precedenti studi comparativi con prodotti standard hanno già dimostrato di determinare un più lungo tempo di dimezzamento del FVIII e nel contempo un miglior comportamento nell’area sotto la curva (AUC). L’obiettivo dichiarato dagli autori è stato quello di valutare i profili PK del FVIII peghilato (Jivi) e del FVIIIFc (Elocta) mediante uno studio crossover randomizzato aperto a singola dose.
Fig.2 Organizzazione dello studio
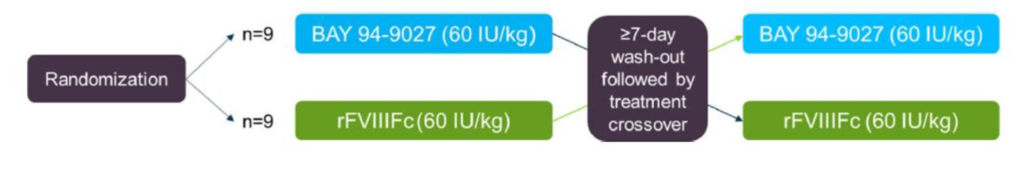
Dopo un periodo di wash-out (3 giorni per i prodotti standard FVIII/SHL e 5 giorni per prodotti FVIII/EHL), i pazienti sono stati randomizzati nel rapporto di 1:1 in due gruppi. In un primo momento un gruppo è stato sottoposto ad una singola infusione di 60 UI / kg BAY 94-9027 (Jivi) e l’altro a 60 UI / kg rFVIIIFc (Elocta). In seguito gli stessi pazienti, dopo una sospensione di 7 giorni (wash-out), invertivano il trattamento (fig.2). Il trattamento in ogni gruppo era eseguito ovviamente per via endovenosa con una durata di 10 minuti.
I soggetti arruolati sono stati pazienti di età compresa tra 18 e 65 anni con emofilia A grave e con una storia clinica che potesse registrare almeno 150 giorni di esposizione al trattamento con FVIII. Ovviamente nessuno dei pazienti annoverava una storia di inibitore contro il FVIII. Un paziente all’inizio dell’arruolamento è stato identificato come portatore di IGM anti PEG preesistenti alla somministrazione di FVIII Peghilato e per queste ragioni escluso dall’analisi della PK. L’analisi quindi è stata condotta su un totale di 17 pazienti.
Altri criteri di arruolamento fondamentali sono stati rappresentati da un indice di massa corporea di 18-29.9 Kg/m2 e da nessuna controindicazione clinica alla sospensione del trattamento con FVIII per il wash-out pre-arruolamento e per quelli necessari nel corso dello studio. (Tab.1)
Tab. 1 – caratteristiche della popolazione arruolata. 
Nell’insieme dell’analisi dei 17 pazienti la media geometrica per l’AUC è stata significativamente più ampia per BAY 94-9027 rispetto a r-FVIIIFc (2940 UI h / dL contro 2360 IU h / dL, p= 0,0001). La clearance è stata significativamente ridotta con il FVIII Peghilato versus quello con FVIII-Fc ( 0.0200 contro 0.0250 dl/h/kg con un p=0.0001).Infine la media geometrica del t.1/2 è stata significativamente più lunga per il FVIII Peghilato (Jivi) rispetto al FVIIIFc (Elocta) 16.3 versus 15.2, p=0.05) (Tab2).
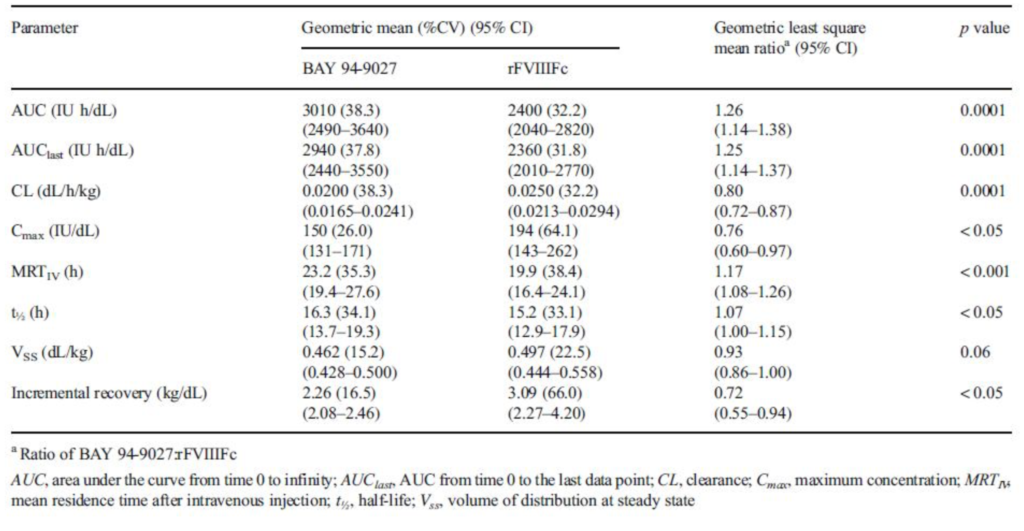
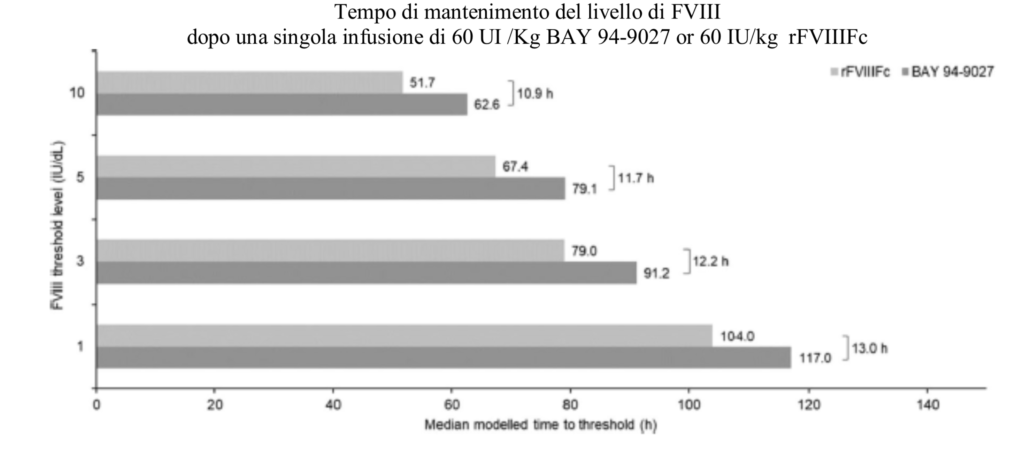
In conclusione il Bay 94-90027 (JIVI) presenta un t.1/2 più prolungato, un AUC (area sotto la curva) decisamente più estesa ed infine la capacità di mantenere mediamente più a lungo livelli superiori ad1UI/dl dopo una singola infusione di 60 UI di FVIII, nei pazienti Emofilici gravi, quando paragonato al comportamento del FVIIIFc (Elocta) (Fig.2).
Ovviamente sarà la pratica clinica a confermare se questi dati potranno corrispondere ad un miglior controllo degli episodi emorragici.
RIFERIMENTI
- Mahlangu J, Young G, Hermans C, Blanchette V, Berntorp E, Santagostino E (2018) Defining extended half-life rFVIII-A critical review of the evidence. Haemophilia 24(3):348–358. https://doi org/10.1111/hae.13438
- Valentino LA, Pipe SW, Collins PW, Blanchette VS, Berntorp E, Fischer K, Ewenstein BM, Oh M, Spotts G (2016) Association of peak factor VIII levels and area under the curve with bleeding in patients with haemophilia A on every third day pharmacokinetic guided. Haemophilia 22(4):514–520. https://doi.org/10.1111/hae.12905
- Hermans C, Mahlangu J, Booth J, Schutz H, Santagostino E,YoungG, Lee HY, Steinitz- Trost KN,Blanchette V,Bertrop E (2018) Pharmacokinetic modelling and validation of the half-life extension needed to reduce the burden of infusions compared with standard factor VIII. Haemophilia 24(3):376–384. https://doi.org/10.1111/ hae.13483
- Coyle TE, Reding MT, Lin JC, Michaels LA, Shah A, Powell J (2014) Phase I study of BAY 94-9027, a PEGylated B-domain deleted recombinant factor VIII with an extended half-life, in subjects with hemophilia A. J Thromb Haemost 12(4):488–496
- Shah A, Coyle T, Lalezari S, Fischer K, Kohlstaedde B, Delesen H, Radke S, Michaels LA (2018) BAY 94-9027, a PEGylated recombinant factor VIII, exhibits a prolonged half-life and higher area under the curve in patients with severe haemophilia A: comprehen sive pharmacokinetic assessment from clinical studies. Haemophilia 24(5):733–740. https://doi.org/10.1111/hae.13561
- Reding MT, Ng HJ, Poulsen LH, Eyster ME, Pabinger I, Shin HJ, Walsch R, LedermanM, WangM, HardtkeM,Michaels LA (2017) Safety and efficacy of BAY 94-9027, a prolonged-half-life factor VIII. J Thromb Haemost 15(3):411–419. https://doi.org/10.1111/jth.13597
- Reding MT, Ng HJ, Tseneklidou-Stoefer D, Linardi C, Laelzari S (2018) Safety of long-term prophylaxis with BAY 94-9027: interim results of >5 years of treatment in the PROTECT VIII extension trial. Haemophilia 24(S5):W-P-001 (404)
- Swedish Orphan Biovitrum AB (2016) Elocta® (recombinant human coagulation factor VIII, Fc fusion protein). Summary of Product Characteristics. http://www.ema.europa.eu/docs/en_GB/document_library/EPAR__Product_Information/human/003964/WC500198642.pdf. Accessed 07 Jan 2019
- Mahlangu J, Powell JS, Ragni MV, Chowdary P, Josephson NC, Pabinger I, Hanabusa H, Gupta N, Kulkarni R, Fogarty P, Perry D, Shapiro A, Pasi KJ, Apte S, Nestorov I, Jiang H, Li S, Neelakantan S, Cristiano LM, Goyal J, Sommer JM, Dumont JA, Dodd N, Nugent K, Vigliani G, Luk A, Brennan A, Pierce GF,Investigators AL (2014) Phase 3 study of recombinant factor VIIIFc fusion protein in severe hemophilia A. Blood 123(3):317–325.https://doi.org/10.1182/blood-2013-10-529974
- Anita Shah, Alexander Solms, Sara Wiegmann, Maurice Ahsman, Erik Berntorp, Andreas Tiede, Alfonso Iorio, Maria Elisa Mancuso, Tihomir Zhivkov, Toshko Lissitchko (2019) Direct comparison of two extended-half-life recombinant FVIII products: a randomized, crossover pharmacokinetic study in patients with severe hemophilia A Annals of Hematology https://doi.org/10.1007/s00277-019-03747-2



