Lo sviluppo di anticorpi neutralizzanti anti-FVIII, chiamati inibitori, è una seria conseguenza non intenzionale della terapia sostitutiva con FVIII che colpisce fino a un terzo dei pazienti con emofilia A grave e un numero minore ma ancora significativo di pazienti con emofilia A lieve o moderata . Le ragioni per cui alcuni pazienti sviluppano questa deleteria risposta immunitaria mentre altri mantengano una tolleranza periferica al FVIII sono attualmente sconosciute. L’attuale approccio per sradicare gli inibitori è l’induzione dell’immuno-tolleranza mediante terapia intensiva con FVIII ma con risultati non sempre soddisfacenti E’questo dunque un campo di ricerca estremamente interessante e di grande importanza nella comprensione dei meccanismi della comparsa della risposta immunomediata. La ricerca di presidi terapeuti per contrastare tale risposta è dunque di grande importanza per il paziente emofilico con Inibitore.
Zerra ed altri si inseriscono in questo filone di ricerca introducendo un nuovo approccio per esplorare le risposte immunitarie anti-FVIII manipolando componenti cellulari della zona marginale della milza (ZM) in topi knockout per il FVIII (FVIII-KO/ carenti di F.VIII).
Diversi studi hanno già dimostrato l’accumulo di FVIII nel seno marginale della milza dopo la sua somministrazione a topi deficenti di FVIII o di von Willebrand factor (VWF). Il Fatt VIII così infuso viene veicolato dal sangue e filtrato dalla milza, che può iniziare la risposta immunitaria rapidamente, subito dopo l’assorbimento dell’antigene del Fatt.VIII. Controprova ne è che topi splenectomizzati prima dell’esposizione al FVIII mostrano una risposta anticorpale significativamente ridotta. È interessante notare che il VWF, che in circolo si complessa al FVIII ( funzione di chaperone ) , si localizza nella polpa rossa splenica, mentre il FVIII si localizza preferenzialmente nella Zona Marginale della Milza. La deplezione di macrofagi e dei CD11c + CD8α – delle cellule dendritiche determinano un’attenuazione della risposta anticorpale anti-FVIII nei topi FVIII-KO, dimostrando un ruolo importante di queste cellule nella formazione di inibitori. La ZM della milza è un microambiente distinto che circonda la polpa bianca, contenente cellule dendritiche residenti, macrofagi metallofili e cellule B. Oltre a queste cellule residenti, le cellule circolanti, comprese le cellule dendritiche, i macrofagi e le cellule T, passano attraverso la ZM come parte della sorveglianza immunitaria nei confronti dei patogeni. Tutte le cellule che migrano verso la polpa bianca splenica devono passare attraverso la ZM. Le cellule B della ZM hanno proprietà sia delle cellule immunitarie innate che adattive e, a differenza delle cellule follicolari (FO) B, possono potenzialmente attivare cellule T CD4 +. Possono rispondere agli antigeni presenti sui macrofagi, sulle cellule dendritiche o sui neutrofili, determinando produzione di plasmacellule/immunoglobuline M (IgM) . Le cellule B della ZM possono anche produrre bassi livelli di IgG e IgA. Possono agire inoltre come “navette” trasferendo antigeni alle cellule dendritiche follicolari. Nei topi, la ritenzione delle cellule B della ZM richiede il legame delle integrine α L β 2 e α 4 β 1 alle molecole di adesione ICAM1 e VCAM1, rispettivamente. Molte cellule murine B della ZM esprimono entrambi i recettori polireattivi delle cellule B in grado di legare più determinanti microbici e recettori Toll-like; il doppio innesto di questi recettori stimola la generazione di anticorpi a bassa affinità in anticipo di anticorpi specifici ad alta affinità successivamente prodotti da percorsi follicolari ed extrafollicolari. Le cellule murine B della ZM riconoscono anche opsonine del complemento e lipidi microbici, così come gli antigeni delle proteine, attraverso la classe maggiore di istocompatibilità di superficie II, CD80 e CD86.
Nello studio di Zerra i topi FVIII-KO hanno ricevuto iniezioni di FVIII in presenza di acido policitidilico (PIC) per indurre uno stato proinfiammatorio rispetto ad un gruppo di controllo. Come previsto, i titoli anticorpali anti-FVIII nei topi esposti a PIC erano più alti. Un altro gruppo di topi FVIII-KO sono stati sottoposti a iniezioni intraperitoneali seriali di anticorpi specifici nei confronti di integrine α L e α 4 , rilasciando quindi le cellule B dalla MZ, prima dell’innesco con FVIII. Questa deplezione delle cellule B della ZM ha ridotto significativamente i titoli anticorpali IgG anti-FVIII e contestualmente i titoli Bethesda. Dopo aver consentito alle cellule B di ripopolare la ZM e dopo un nuovo stimolo con FVIII, i topi hanno sviluppato inibitori, sebbene con titoli inferiori a quelli dei topi di controllo . Questo starebbe ad indicare che la deplezione delle cellule B della ZM impediva lo sviluppo iniziale dell’inibitore, ma non induceva tolleranza periferica al FVIII. Dunque questi risultati, insieme alla localizzazione osservata di FVIII sulle cellule B della ZM, suggeriscono un ruolo importante per le cellule B della MZ come iniziatori della risposta immunitaria anti-FVIII. E’ possibile che gli anticorpi utilizzati per bloccare il legame con l’integrina interferiscano anche con altre rilevanti interazioni di legame e / o con vie di segnalazione cellulare. Inoltre, l’esaurimento di un tipo di cellula può ben influenzare le interazioni e i fenotipi delle cellule vicine, complicando le interpretazioni. È possibile che il FVIII sia trasportato alle cellule follicolari dendritiche sia dai macrofagi e sia dalle cellule B della ZM, e meccanismi non esclusivi di spola di antigeni e presentazione possono prevalere in base allo stato immunitario dell’animale e al microambiente della ZM.
E ‘interessante confrontare i risultati di Zerra con uno studio di Zhang et al di qualche anno addietro in cui le cellule follicolari B e quelle della ZM erano esauste dopo stimolo da FVIII esogeno; l’esaurimento delle cellule follicolari B da solo seguito da una intensa somministrazione di FVIII ha aumentato i livelli di cellule T regolatorie spleniche, diminuito i successivi titoli inibitori e le molecole B7 costimolatori nei confronti delle cellule B della ZM, suggerendo che le cellule B della ZM possono svolgere un ruolo tollerogenico in alcune condizioni.
Complessivamente il lavoro di Zerra e colleghi evidenzia l’importanza della ZM splenica nell’iniziare le risposte immunitarie anti-FVIII e focalizza l’attenzione sul ruolo delle cellule spleniche B della ZM, cellule polifunzionali che collegano l’immunità innata e adattativa. I ruoli del VWF nell’immunogenicità del FVIII, e le possibili differenze nei confronti di prodotti innovativi del FVIII (ad esempio, ricombinanti standard e/o Longactin) sono già oggetto di studio in più laboratori. Dunque i dati della risposta immunitaria anti-VIII ,basata sui risultati del presente studio, rappresentano sicuramente un approccio particolarmente promettente per identificare nuovi bersagli terapeutici per la prevenzione della comparsa degli di inibitori.
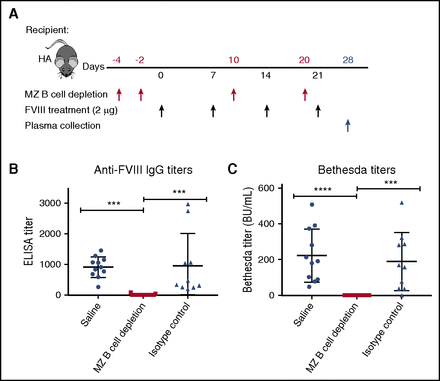
Fig.1 – L’esaurimento delle cellule MZ B spleniche impedisce lo sviluppo di anticorpi anti-FVIII. (A) I topi FVIII-KO sono stati trattati con anticorpi anti-MZ B, un anticorpo di controllo isotipo o salina (frecce rosse) a partire da 4 giorni prima delle esposizioni iniziali a dosi intermedie di FVIII (frecce nere). Il plasma è stato raccolto 1 settimana dopo la quarta infusione settimanale di FVIII (freccia blu) e analizzato mediante saggio di immunoassorbimento enzimatico (ELISA) (B) e test di Bethesda (C) per determinare i titoli anticorpali anti-FVIII totali e inibitori, rispettivamente. La deplezione delle cellule B della MZ ha completamente azzerato la risposta anticorpale anti-FVIII innescata, indicando un ruolo chiave per le cellule MZ B nell’iniziare la risposta immunitaria ingenua anti-FVIII. Il grafico è stato adattato dalla Figura 3A-C presente nell’articolo di Zerra et al Blood. 2017;130(23):2559-256
RIFERIMENTI:
- Zerra PE, Cox C, Baldwin WH, et al Marginal zone B cells are critical to factor VIII inhibitor formation in mice with hemophilia A. Blood. 2017;130(23):2559-2568.
- Shima M, Hanabusa H, Taki M, et al Factor VIII-mimetic function of humanized bispecific antibody in hemophilia A. N Engl J Med. 2016;374(21):2044-2053.
- Mebius RE, Kraal G Structure and function of the spleen. Nat Rev Immunol. 2005;5(8):606-616.
- Navarrete A, Dasgupta S, Delignat S, et al Splenic marginal zone antigen-presenting cells are critical for the primary allo-immune response to therapeutic factor VIII in hemophilia A. J Thromb Haemost. 2009;7(11):1816-1823.
- van Schooten CJ, Shahbazi S, Groot E, et al Macrophages contribute to the cellular uptake of von Willebrand factor and factor VIII in vivo. Blood. 2008;112(5):1704-1712.
- Attanavanich K, Kearney JF Marginal zone, but not follicular B cells, are potent activators of naive CD4 T cells. J Immunol. 2004;172(2):803-811.
- Zhang AH, Skupsky J, Scott DW Effect of B-cell depletion using anti-CD20 therapy on inhibitory antibody formation to human FVIII in hemophilia A mice. Blood. 2011;117(7):2223-2226.
- Pipe SW, Montgomery RR, Pratt KP, Lenting PJ, Lillicrap D Life in the shadow of a dominant partner: the FVIII-VWF association and its clinical implications for hemophilia A. Blood. 2016;128(16):2007-2016.