I prodotti non sostitutivi non hanno modificato l’importanza strategica dell’ITI
L’introduzione nella pratica clinica delle terapie innovative con prodotti non sostitutivi ( NFT – nonfactor therapies -) stanno modificando gli approcci terapeutici all’emofilia, in special modo per quello che riguarda la gestione degli inibitori. Un interessante editoriale è recentemente comparso su Haemophilia (2019) a firma Aledort che qui cerchiamo di riassumere.
Per decenni le sole opzioni cliniche per la gestione dei pazienti con inibitore sono state limitate al complesso protrombinico attivato (aPCC) e al fattore VII ricombinante attivato (rFVIIa). Seppur siano stati e siano tutt’ora presidi fondamentali nella gestione dell’inibitore, la loro efficacia clinica è sempre stata imprevedibile ed inoltre di questi non si è mai avuto a disposizione sistemi affidabili di monitoraggio di laboratorio.
Ovvio l’entusiasmo e le attese per l’innovativo approccio clinico dei NFT.
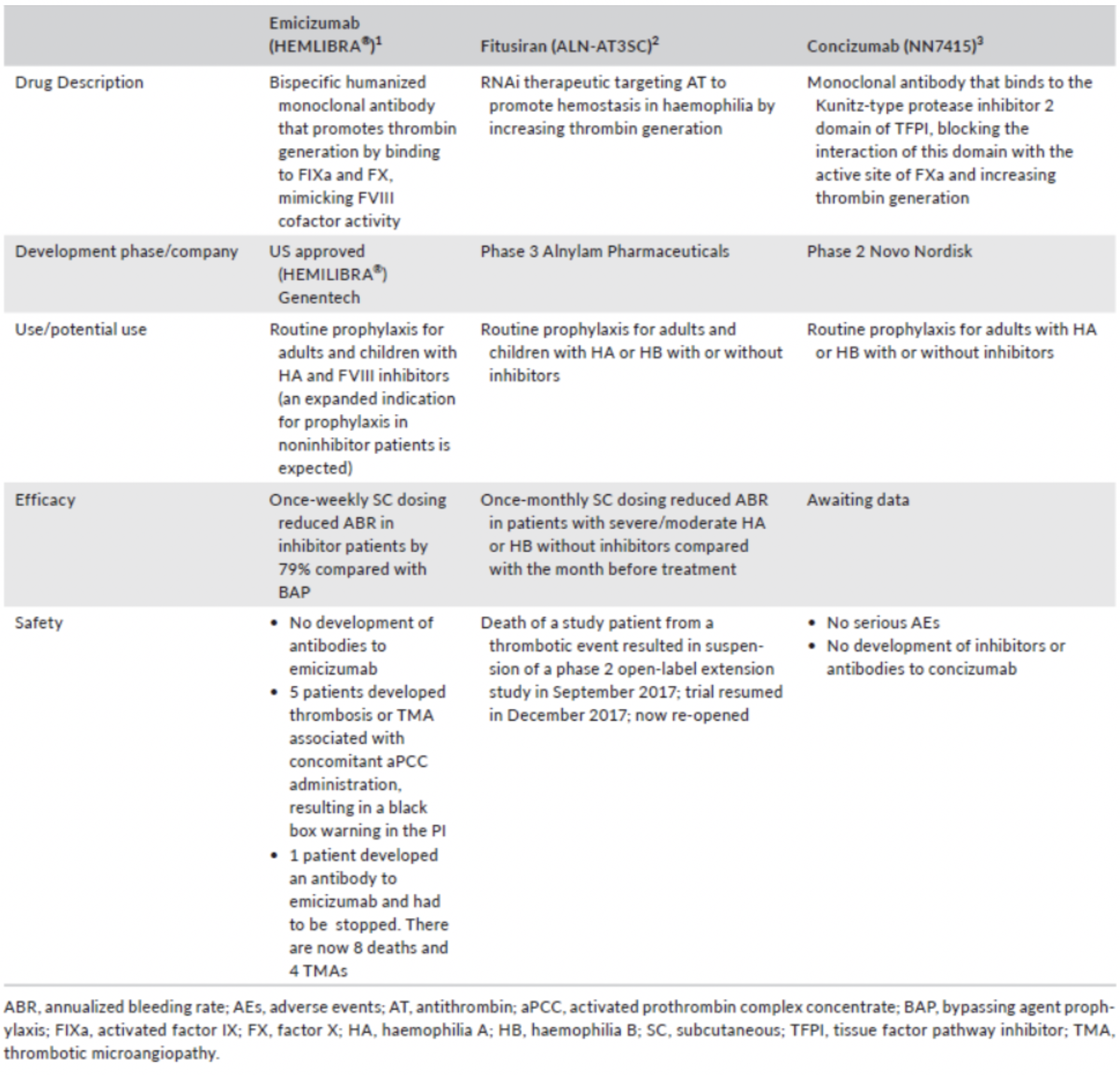
L’emicizumab, già approvato sia dall’FDA che dall’EMA, con fitusiran e concizumab, in attesa di approvazione (Tabella 1), giocano e giocheranno sicuramente sempre più un ruolo non secondario nella profilassi dei pazienti con e senza inibitori.
I NFT sono da alcuni clinici considerati una strategia importante per evitare lo sviluppo di inibitori eliminando o minimizzando l’esposizione alla terapia sostitutiva con i fattori standard plasmaderivati o ricombinati .
Inoltre tutti e tre gli agenti vengono somministrati per via sottocutanea, facilitando notevolmente l’aderenza ai regimi profilattici e riducendo il disagio ai pazienti.
Tab.1
Tuttavia nonostante queste prospettive, allo stato attuale gli NFT non rappresentano una soluzione definitiva alla complicanza della comparsa degli inibitori e non ovviano alla necessità di eradicare l’inibitore.
Le evidenze cliniche confermerebbero che la scelta dei NFT per la profilassi di routine non garantisce una sicurezza pari al 100% dai sanguinamenti.
Anche nell’ultimo studio di efficacia di fase 1 del Fitusiran, che ha arruolato 25 pazienti con emofilia A o B senza inibitori con l’obiettivo di determinare la corretta dose per la profilassi, gli episodi emorragici segnano una “riduzione apparente”, ma non vicino a valori zero (Pasi 2017).
Gli NFT inoltre non sono utili nel trattamento di sanguinamenti acuti e la loro applicazione per la profilassi chirurgica è dibattuta.
Pertanto in queste situazioni avremo ancora la necessità di ricorrere ai concentrati di F.VIII e IX e a continuare a convivere con il rischio della comparsa degli inibitori, in particolare in corso di terapie intensiva.
Gli NFT potrebbero invece essere particolarmente utili per i pazienti con inibitori ad alto titolo che hanno fallito l’immunotolleranza (ITI) e che non possono esservi candidati o che rifiutino l’ITI.
Lo studio di fase 3 sulla valutazione dell’efficacia in profilassi dell’emicizumab in pazienti con emofilia A con inibitori ha potuto dimostrare una riduzione dell’incidenza annuale del sanguinamento (ABR) del 79%, rispetto alla profilassi con agenti bypassanti (Oldenburg 2017). Tuttavia, così come avviene per i pazienti senza inibitori, l’uso di NFT non si traduce in un ABR zero per ogni paziente .
Quindi gli Agenti bypassanti, allo stato attuale, anche con l’introduzione dei NFT, saranno sempre necessari per il controllo di eventuali sanguinamenti traumatici, seppur sempre con il rischio di avere una risposta clinica imprevedibile e variabile. Inoltre dobbiamo anche aspettarci possibili complicanze, così come evidenziato dal sanguinamento fatale in un trattamento con emicizumab in un paziente con inibitore dopo somministrazione di 11 dosi di rFVIIa.(Oldenburg 2017).
Infine, dobbiamo tener in conto che l’uso di agenti bypassanti con emicizumab possono essere responsabili di trombosi e di microangiopatia trombotica, quest’ultima condizione evento avverso mai osservato con l’uso di aPCC o rFVIIa .
Dunque l’emicizumab e gli altri NFT, nonostante rappresentino uno sviluppo importante della ricerca, non sono in grado di mettere al riparo i pazienti con emofilia dal rischio di sanguinamento e dalla possibile comparsa dell’inibitore. Questo rafforza il concetto dell’assoluta importanza dell’immunotolleranza là dove questa sia possibile.
Ulteriore considerazione sulla necessità d’eradicazione dell’inibitore è che, in questa condizione, viene loro preclusa la partecipazione alla terapia genica, forse l’unica vera terapia potenzialmente risolutiva (Arruda 2016).
Anche nel prossimo futuro l’eradicazione dell’inibitore continuerà quindi ad essere per gli emofilici A, adulti e bambini, un imprescindibile obbiettivo (più problematica la decisione di intraprendere ITI nei pazienti con emofilia B a causa del rischio di gravi reazioni allergiche e sindrome nefrosica).
A tutt’oggi l’ITI è l’unica strategia comprovata per sconfiggere gli inibitori nei pazienti con l’emofilia A e ripristinare la normale farmacocinetica del FVIII.
Questo approccio terapeutico, sia utilizzando alte che basse dosi, assicura circa il 70% di successo secondo quanto riportato da Di Michele DM, et al. già nel corso de “International workshop on immune tolerance induction: consensus recommendations” (Hemophilia 2007) .
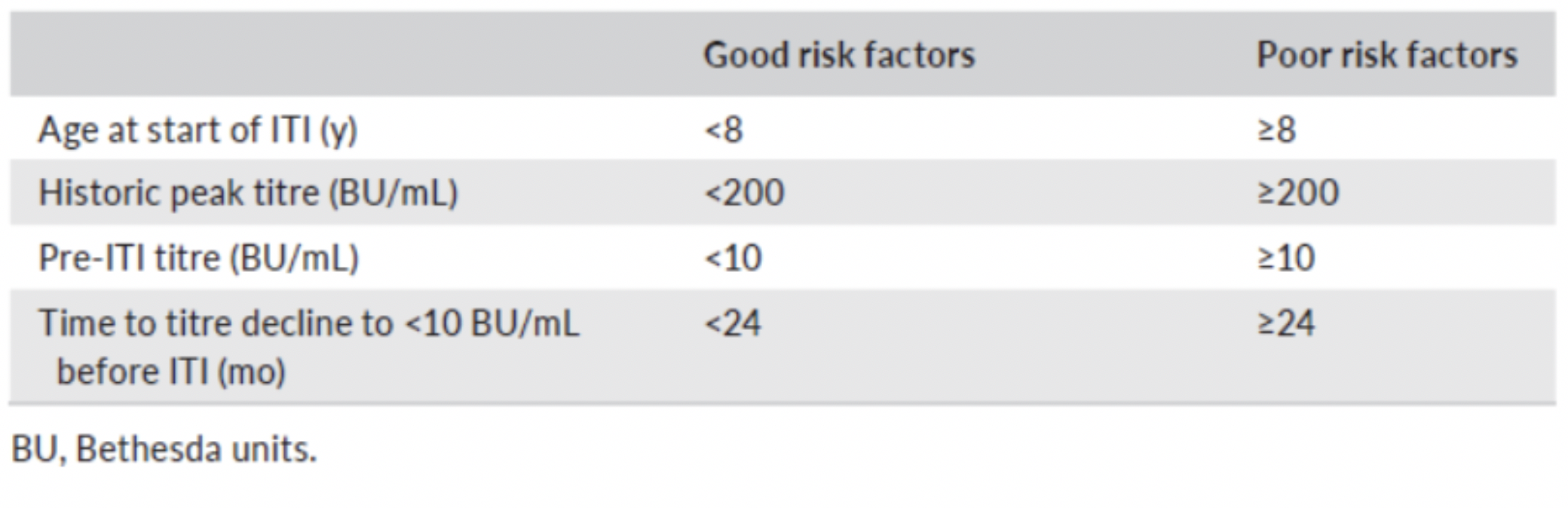
Le linee guida internazionali forniscono raccomandazioni per l’ITI per la selezione dei candidati, la tempistica, il regime terapeutico, il controllo clinico e gli indici di successo (Tabella 2).
Tab.2
Queste linee guida suggeriscono anche i criteri di scelta del prodotto: FVIII derivato dal plasma (pd FVIII) o FVIII ricombinante (rFVIII)
L’ITI è generalmente iniziata con il concentrato FVIII utilizzato dal paziente al momento dello sviluppo dell’inibitore.
Dobbiamo però registrare esperienze con conclusioni non sempre concordanti..
Lo studio (SIPPET) ha mostrato una minore incidenza di sviluppo di inibitori in pazienti precedentemente non trattati o minimamente trattati che hanno usato concentrati di pd-FVIII contenenti il fattore di von Willebrand (VWF) rispetto a rFVIII (Peyvandi 2016).
Studi in vitro suggerirebbero che i concentrati di FVIII contenenti VWF possono essere più efficaci nell’indurre la tolleranza immunitaria perché il VWF maschera gli epitopi responsabili della risposta immunitaria, proteggendo così il FVIII infuso dalla rapida degradazione.
Altri autori suggeriscono che inibitori diretti contro il dominio A2 e la catena leggera di FVIII sono meno attivi contro il FVIII associato a VWF rispetto al F.VIII privo VW (Gensana 2001). Tuttavia permangono molte incertezze su queste ipotesi e le esperienze sono contrastanti.
Comunque questi risultati hanno persuaso alcuni clinici ad utilizzare pdFVIII / VWF sempre più in prima linea per ITI.
Di contro in letteratura è comparsa una meta-analisi condotta su 13 studi che non ha riportato differenze significative nell’eradicazione dell’inibitore tra i pazienti trattati esclusivamente con concentrati di pdFVIII / VWF e quelli trattati esclusivamente concentrati di FVIII privi di VWF (sebbene la percentuale di pazienti a basso rischio era più alta in quelli trattato con pdFVIII / VWF) ( van Velzen 2014).
Ed infine l’esperienza di un gruppo di clinici in Germania suggerisce che l’ITI potrebbe avere migliori risultati quando venga usato il protocollo di Bonn con alte dosi (FVIII 150 UI / kg due volte al giorno) e con concentrati di pdFVIII / VWF (87% ‐91%), rispetto all’utilizzo di un rFVIII (29% -54%) ( Kreuz 2001). Segnaliamo comunque che attualmente è in corso uno studio randomizzato sull’emofilia A, con risposta elevata agli inibitori e con prognosi sfavorevole per l’eradicazione degli stessi, per risolvere il problema della selezione dei prodotti (NCT01051544)
In conclusione, gli NFT sono una risorsa che suscita molte aspettative e sono certamente benvenuti nell’armamentario farmacologico dell’emofilia. Tuttavia, la loro inclusione in algoritmi di trattamento non dovrebbe portare a trascurare il rischio e le possibili complicanze dovute alla comparsa degli inibitori. L’imperativo per i clinici di eradicare gli inibitori non è cambiato e si deve continuare a cercare di identificare le migliori strategie per indurre la tolleranza immunitaria nei bambini e negli adulti. Certamente poi un’area di estremo interesse, una volta ottenuta l’immunotolleranza, è il loro utilizzo nella profilassi quale terapia non sostitutiva.
Riferimenti
- AledortM. The ongoing imperative for immune tolerance induction in inhibitor management. Haemophilia. 2019;25:183–186.
- Oldenburg J, Mahlangu JN, Kim B, et al. Emicizumab prophylaxis in hemophilia A with inhibitors. N Engl J Med. 2017;377(9):809‐818.
- Pasi KJ, Rangarajan S, Georgiev P, et al. Targeting of antithrombin in hemophilia A or B with RNAi Therapy. N Engl J Med. 2017;377(9):819‐828.
- Gouw SC, van der Bom JG, Auerswald G, Ettinghausen CE, Tedgard U, van den Berg HM. Recombinant versus plasma‐derived factor VIII products and the development of inhibitors in previously untreated patients with severe hemophilia A: the CANAL cohort study. Blood. 2007;109(11):4693‐4697.
- Leissinger C, Gringeri A, Antmen B, et al.Roche reports 5 deaths after dosing of Hemlibra. European Biotechnology. https://european-com/up-to-date/latest-news/news/roche-reports-5-deaths-after-dosing-of-hemlibra.html. Accessed 28 March 2018. European Biotechnology.
- Arruda VR, Samelson‐Jones BJ. Gene therapy for immune tolerance induction in hemophilia with inhibitors. J Thromb Haemost. 2016;14(6):1121‐1134.
- DiMichele DM, Hoots WK, Pipe SW, Rivard GE, Santagostino E. International workshop on immune tolerance induction: consensus recommendations. Hemophilia. 2007;13(suppl 1):1‐22.
- Peyvandi F, Mannucci PM, Garagiola I, et al. A randomized trial of factor VIII and neutralizing antibodies in hemophilia A. N Engl J Med.2016;374(21):2054‐2064
- van Velzen AS, Peters M, van der Bom JG, Fijnvandraat K. Effect of von Willebrand factor on inhibitor eradication in patients with severe haemophilia A: a systematic review. Br J Haematol. 2014;166(4):485‐495.
- Kreuz W, Escuriola‐Ettingshausen C, Auerswald G. Immune tolerance induction in haemophilia A patients with inhibitors: the choice of concentrate affecting success. Haematologica.2001;86(suppl 4):16‐20.
- Clinical Trials.gov.Study of first time immunotolerance induction in severe hemophilia A patients with inhibitor at high risk of failure: comparison with FVIII concentrates with or withou von Willebrand factor ‐ RES.I.S.T. naive (RESIST NAIVE); NCT01051544. https://clinicaltrials.gov/ct2/show/NCT01051544?term=NCT01051544&rank=1. Accessed 19 June 2018.