Il mantenimento dell’emostasi è fondamentale per la prevenzione della trombosi e del sanguinamento. La ridotta generazione di trombina e la ridotta formazione di coaguli derivanti dalla carenza di fattori di coagulazione, come l’emofilia, interrompono questo delicato equilibrio e favoriscono il sanguinamento.
La sostituzione dei fattori è lo standard di cura per le persone affette da emofilia nei paesi sviluppati, ma sono necessari prodotti emostatici alternativi se si sviluppano inibitori contro i fattori sostitutivi. Sebbene l’anticorpo bispecifico mimetico del fattore VIII (FVIII) emicizumab abbia migliorato il trattamento dei pazienti affetti da emofilia A con inibitori, la necessità di terapie alternative per soggetti affetti da emofilia B e altri disturbi emorragici rari ha stimolato la generazione di una pletora di nuovi agenti pro-emostatici che interferiscono con diversi passaggi del sistema coagulativo. Tra queste, alcune nuove terapie in grado di inibire in modo sicuro gli anticoagulanti naturali possono rappresentare una soluzione per “riequilibrare” l’emostasi in soggetti con disturbi emorragici ereditari o acquisiti. A tal fine, l’inibizione mediata da anticorpi dell’inibitore della via del fattore tissutale o la soppressione dell’antitrombina mediata da aptameri ha già dimostrato risultati positivi in studi clinici con pazienti affetti da emofilia.
Anche l’inibizione della via della proteina C rappresenta un obiettivo interessante in base al suo ruolo centrale nella regolazione dinamica della generazione di trombina. La proteina C plasmatica viene attivata dalla trombina legata al suo recettore anticoagulante, la trombomodulina, che è abbondantemente espressa sulla parete vascolare. Questo complesso, a sua volta, converte la proteina C nella sua forma attivata, APC, in un processo accelerato dal legame della proteina C al recettore endoteliale della proteina C. L’APC con il suo cofattore proteina S degrada quindi i cofattori pro-coagulanti attivati FVa e FVIIIa per limitare l’ulteriore generazione di trombina. L’APC esiste anche in piccole quantità nel plasma (∼40 pM) e l’attenuazione delle sue proprietà anticoagulanti può aiutare a promuovere la generazione di trombina in soggetti con disturbi emorragici. Sono già stati sviluppati diversi approcci innovativi per ottenere l’inibizione dell’APC. SerpinPC, una variante ricombinante di α1-antitripsina con maggiore specificità per APC, promuove l’emostasi inibendo l’attività anticoagulante di APC ed è attualmente in fase di valutazione in studi clinici di fase II in pazienti affetti da emofilia B. Inoltre, SuperVa, una variante del FVa resistente ad APC, promuove efficacemente la generazione di trombina nei modelli di sanguinamento preclinici. Inoltre, l’inibizione della proteina S anticoagulante, cofattore di APC, promuove l’emostasi nel plasma emofilico e nei modelli preclinici di emofilia. Più recentemente, gli anticorpi monoclonali (mAb) diretti contro l’APC si sono rivelati promettenti nel bloccare direttamente la proteolisi del FVa da parte dell’APC per promuovere l’emostasi.
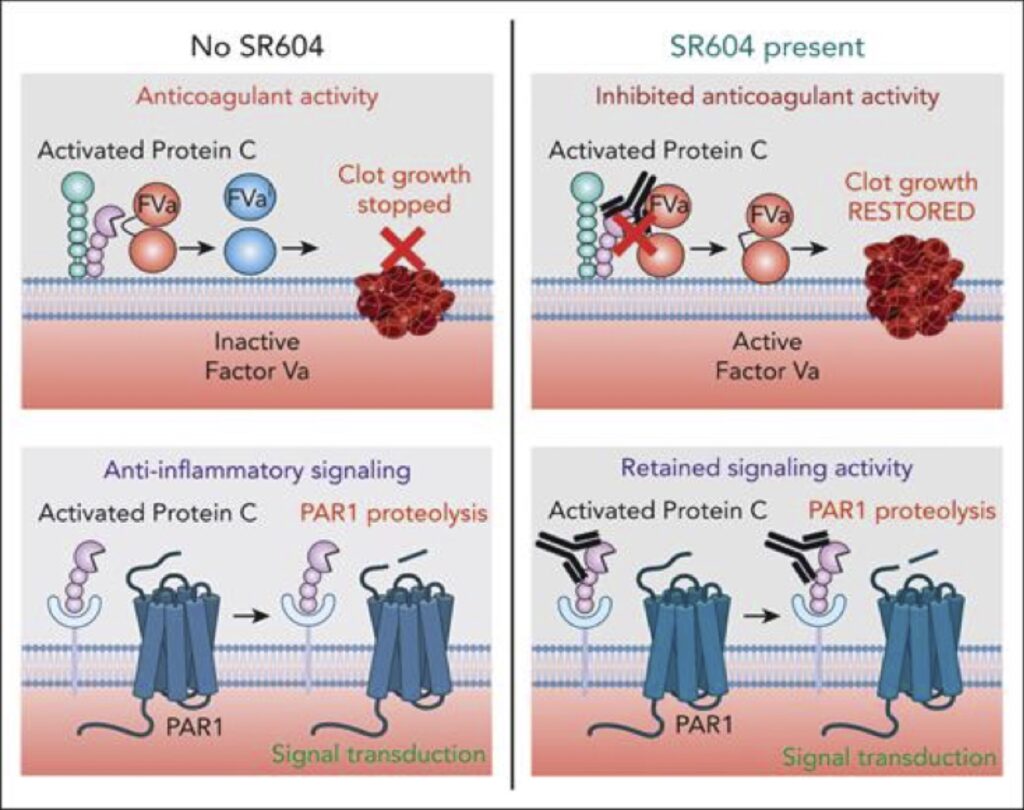
Il mAb anti-APC SR604 ripristina l’emostasi bloccando selettivamente l’attività anticoagulante dell’APC. SR604 si lega con altissima affinità all’APC a un epitopo importante per legarsi al suo substrato, FVa. In tal modo, blocca potentemente l’attività anticoagulante dell’APC per ripristinare la generazione di trombina nei modelli preclinici di emofilia. Al contrario, SR604 non impedisce l’attività antinfiammatoria endogena dell’APC tramite PAR1.
Una preoccupazione fondamentale per la sicurezza delle terapie che inibiscono le vie anticoagulanti è che non “sovrabilancino” l’emostasi favorendo la trombosi. Gli approcci terapeutici che inibiscono l’APC possono avere un’ulteriore considerazione sulla sicurezza, vale a dire l’inibizione involontaria di importanti proprietà dell’APC che sono distinte dal suo ruolo nella regolazione dell’emostasi. L’APC possiede complesse funzioni di segnalazione antinfiammatoria che sono principalmente mediate dalla proteolisi del recettore 1 attivato dalla proteasi (PAR1) sia sulle cellule immunitarie endoteliali che periferiche. È importante sottolineare che il deficit genetico o l’inibizione anticorpale dell’APC possono esacerbare la malattia infiammatoria sia acuta che cronica nei modelli preclinici. Sebbene non sia stata valutata fino ad oggi, è ragionevole supporre che tale possibilità potrebbe verificarsi nei pazienti affetti da emofilia che ricevono terapie bloccanti l’APC che inibiscono tutta l’attività proteolitica. Le ultime iterazioni di anticorpi monoclonali mirati contro APC hanno quindi cercato di attenuare selettivamente le proprietà anticoagulanti di APC senza influenzare la capacità di promuovere la segnalazione di APC. Gli esositi sulla superficie dell’APC necessari per isolare specifiche funzioni dell’APC sono già stati ampiamente caratterizzati.
In questo articolo, Jiang e coll. descrivono lo sviluppo e la caratterizzazione di un mAb umanizzato ingegnerizzato (SR604) progettato per colpire un esosite APC situato all’interno del dominio della proteasi APC che è fondamentale per l’attività anticoagulante ma superfluo per la segnalazione antinfiammatoria dipendente da PAR1. SR604 era basato su un precedente mAb murino (HAPC1573) che legava l’APC ma richiedeva dosi elevate per ripristinare l’emostasi nei modelli animali di emofilia. La valutazione dell’affinità di legame mAb-APC mediante risonanza plasmonica di superficie ha mostrato che SR604 possedeva un’affinità per APC 60 volte superiore rispetto al suo anticorpo genitore. Ciò si è tradotto in una maggiore efficacia emostatica negli esperimenti sul plasma ex vivo, in cui SR604 ha ridotto i tempi di coagulazione in modo dose-dipendente in vari plasmi carenti di fattori di coagulazione con generazione di APC. In vivo, SR604 ha limitato il sanguinamento della coda nei topi emofilici in misura simile al FVIII ricombinante e ha ridotto il sanguinamento articolare e l’artropatia in un modello di lesione del ginocchio eseguito in topi emofilici. È importante sottolineare che gli autori hanno confermato che SR604 non esercita un’inibizione simile dell’attività di segnalazione APC sulle cellule endoteliali, dimostrando che SR604 non ha influenzato la protezione APC mediata da PAR1 della funzione di barriera delle cellule endoteliali dalla permeabilità indotta dalla trombina. Curiosamente, SR604 ha accelerato la proteolisi APC degli istoni extracellulari citotossici, un’altra funzione antinfiammatoria cruciale dell’APC durante l’infezione acuta, suggerendo che SR604 può anche rappresentare uno strumento utile per comprendere meglio le basi meccanicistiche di questa distinta attività antinfiammatoria. Per dimostrare ulteriormente la mancanza di interferenza mediata da SR604 nelle proprietà antinfiammatorie endogene dell’APC, gli autori hanno somministrato SR604 a topi emofilici che erano stati esposti a una dose subletale di lipopolisaccaride (LPS) e hanno dimostrato che, a differenza di un monoclonale anti-proteina C anticorpo che blocca la generazione di APC, il legame di SR604 con APC endogeno non ha provocato un aumento della mortalità in risposta alla sfida con LPS. Questi dati supportano il ridotto impatto dell’SR604 sull’attività antinfiammatoria dell’APC rispetto alla sua potente inibizione dell’attività anticoagulante. Tuttavia, saranno necessari ulteriori studi per una valutazione più granulare del fatto che SR604 moduli altre funzioni di segnalazione APC non canoniche e per determinare se SR604 influisce sulla segnalazione APC in contesti di malattie infiammatorie croniche in cui anche l’APC endogeno è protettivo.
Conclusioni: Sebbene in attesa di valutazione negli studi clinici, le proprietà pro-emostatiche, le limitate tossicità fuori bersaglio e la farmacocinetica favorevole descritte in questo studio suggeriscono che SR604 rappresenta un’entusiasmante aggiunta alla gamma crescente di terapie proemostatiche non basate su fattori e sottolineano il potenziale delle terapie di precisione che mirano alla proteina C selezionata funzioni del percorso. Questo studio fornisce anche un esempio saliente del continuo perfezionamento degli approcci per riequilibrare l’emostasi in modo sicuro, che si prevede amplierà ulteriormente le opzioni terapeutiche disponibili per i soggetti affetti da emofilia e altri disturbi emorragici rari.
THROMBOSIS AND HEMOSTASIS| SEPTEMBER 21, 2023, Blood (2023) 142 (12): 1032–1034.
New targeted therapy for hemophilia
Roger J. S. Preston
https://pubmed.ncbi.nlm.nih.gov/?term=New+targeted+therapy+for+hemophilia