Presentati a Praga i dati del trial di fase 3 di un nuovo Fatt. r-VIIa sottocutaneo
Nel corso del recente 12°Annual Congress of the European Association for Haemophilia and Allied Disorders(EAHAD), tenutosi a Praga nello scorso mese di febbraio c.a. , sono stati presentati i dati di un interessante trial di fase 2/3 di un nuovo Fatt. r-VIIa da somminstrare per via sottocutanea. Il prof Howard Levy, direttore scientifico del Catalyst Biosciences, ha reso noto i dati aggiornati di questo trial durante una sessione di lavori tramite un suo intervento : “Phase 2/3 Trial of Subcutaneous Engineered FVIIa Marzeptacog Alfa Activated in Hemophilia A or B with Inhibitors: Pharmacokinetics, Pharmacodynamics, Efficacy and Safety”
Marzeptacog alfa attivato (MarzAA), nuova variante del fattore VII umano attivato ricombinante (rFVIIa),9 volte più potente del Eptacog Alfa Attivato (novoseven),è stato sviluppato per fornire ai pazienti con emofilia un prodotto con maggiore attività procoagulante e una maggiore durata d’azione.
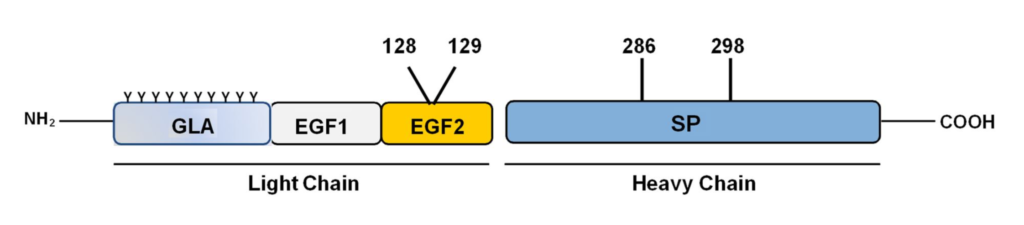
MarzAA è una glicoproteina a catena singola cataliticamente clivata in una catena pesante e in una catena leggera. La configurazione a due catene rappresenta la forma attiva del fattore K-dipendente. L’attività enzimatica di FVIIa è potenziata dalla sua interazione con TF (fattore tessutale).
MarzAA è una variante ricombinante del FVIIa umano caratterizzato in sintesi da quattro cambiamenti nella sequenza aminoacidica primaria. Due cambiamenti sono rappresentati dagli amminoacidi Q286R e M298Q e rientrano nella regione della catena pesante del FVIIa nel dominio catalitico, gli altri due cambiamenti, T128N e P129A rientrano nel dominio EGF2 (Fig1).
In uno studio precedente, di fase 1, erano stati arruolati soggetti con emofilia A e B grave con e senza inibitori. End point primario di questo studio è stato indagare su sicurezza, tollerabilità, immunogenicità, farmacocinetica (PK) e farmacodinamica (PD) di MarzAA per dosi crescenti somministrate per via endovenosa in pazienti con emofilia congenita A o B con o senza inibitori in assenza di eventi emorragici.

Fig.1 Sintesi delle caratteristiche del MarzAA
Questo studio, aperto e a carattere internazionale (NCT01439971), ha arruolato maschi di età compresa tra 18 e 64 anni con emofilia A o B grave, con o senza inibitori. I soggetti sono stati suddivisi in gruppi, ognuno dei quali riceveva una singola dose di MarzAA da 0,5, 4,5, 9, 18 o 30 μg/ kg pc. I prelievi di sangue sono stati effettuati prima e dopo l’iniezione sottocutanea del farmaco e i soggetti sono stati monitorati per 60 giorni dopo ogni somministrazione. Gli end point di sicurezza includevano eventuali eventi avversi, cambiamenti dei segni vitali, elettrocardiogramma, anomalie di laboratorio e di immunogenicità; gli end point secondari includevano la valutazione di PK e PD. Complessivamente, in 25 pazienti, MarzAA è stato ben tollerato con tutte le dosi testate e non sono state registrate manifestazioni di tossicità, ne si sono verificati eventi avversi gravi. MarzAA ha mostrato un PK lineare dose-risposta nell’intervallo delle dosi tra 4,5 e 30 μg kg-1, con un’emivita terminale di ⁓ 3,5 ore. Con tutte le dosi è stato osservato un accorciamento dose-dipendente del tempo di tromboplastina parziale attivata e del tempo di protrombina. Contemporaneamente vi è stata evidenza di un aumento dell’attività della trombina determinata con il test della generazione.
Questi risultati positivi sono stati originariamente presentati nel 2015 nel corso delle sessioni del Congresso della Società internazionale di Trombosi ed Emostasi (ISTH) e sono poi stati recentemente pubblicati nel 2018 sul Journal of Thrombosis and Hemostasis.
Marzeptacog alfa (attivato) ha così ottenuto la designazione di farmaco orfano da parte della Food and Drug Administration (FDA) statunitense per la profilassi di routine per prevenire episodi di sanguinamento in soggetti con emofilia A o B con inibitori.
Allo stesso modo dello studio di fase 1 anche i primi dati clinici dello studio di fase 2/3, attualmente in corso, sono estremamente positivi. Quest’ultimo è stato avviato in nove centri e precisamente in Armenia, Georgia, Polonia, Russia e Sud Africa. Attualmente 17 sono i soggetti arruolati, sette dei quali hanno completato lo studio, due in via di completamento, gli altri sono nella fase preliminare per la validazione dell’idoneità allo studio.
I pazienti che hanno completato lo studio sono stati sottoposti ad un regime di profilassi con iniezioni sottocutanee di 30 microgrammi/die di MarzAA per kg/p.c per 50 giorni. Il protocollo ha previsto, in caso di mancato controllo degli episodi emorragici spontanei, la possibilità di aumentare il dosaggio fino a un massimo di 120 μg / kg/p.c.
Questo gruppo di pazienti, prima di entrare nel protocollo di valutazione del MarzAA, presentava una frequenza media di sanguinamento annualizzata (ABR) di 19,0 (compresa tra 12,2 e 26,7) (Fig.2). Inoltre si sottolinea come i pazienti avessero, sempre prima dell’arruolamento, mediamente il 12,2% delle loro giornate interessate da sanguinamento (Fig.3).
I sette pazienti che hanno completato il protocollo di studio hanno presentato nel corso del protocollo una riduzione clinicamente significativa dell’ABR (Fig.2). I clinici sottolineano inoltre che ben cinque pazienti non hanno presentato sanguinamenti (traumatici o spontanei) nel periodo di osservazione.
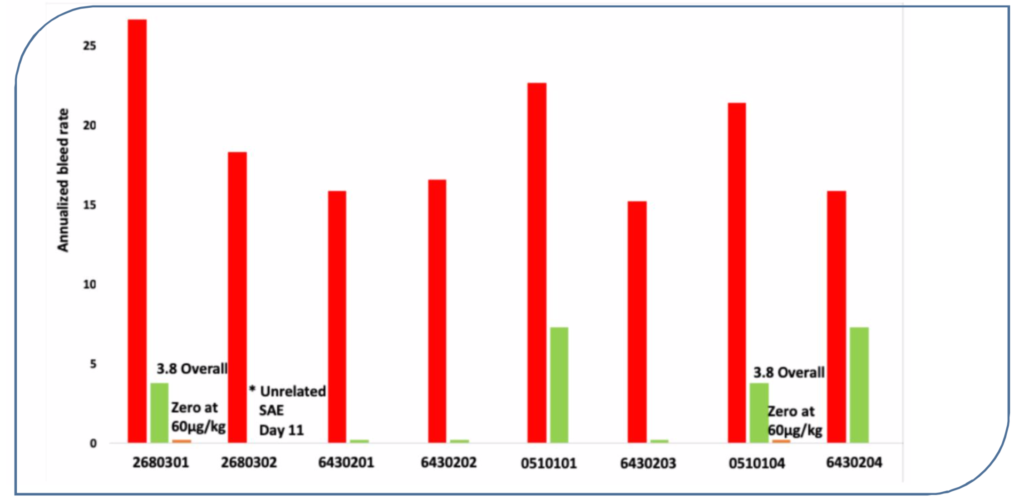
Fig.2 riduzione dell’ABR nel periodo di trattamento (H.Levy 2019)
Invece, sempre per i sette pazienti che hanno completato lo studio, la mediana della percentuale dei giorni interessati dal sanguinamento prima del trattamento era dell’11,0%, che si riduce ad una mediana dell’1,0% durante il periodo di trattamento.
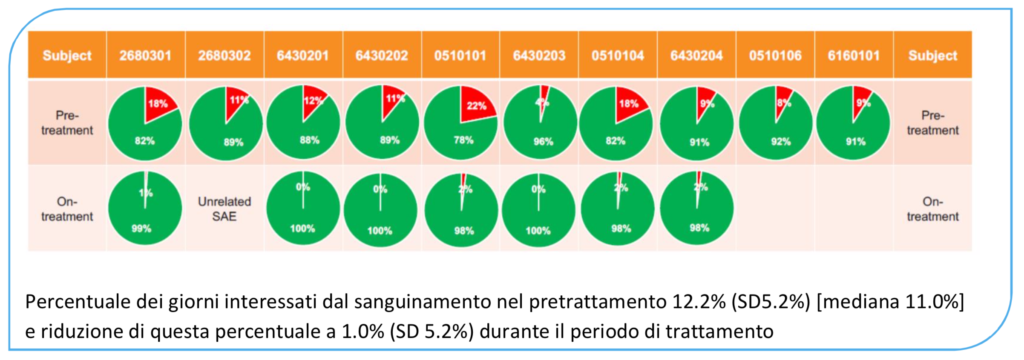
Fig.3 percentuale delle giornate interessate da sanguinamenti spontanei (H.Levy 2019)
Dopo più di 450 giorni di iniezioni sottocutanee di MarzAA, sono state registrate solo sei reazioni avverse nel sito di iniezione in due soggetti. Queste sono consistite in modesti segni di gonfiore e rossore a rapida risoluzione. Infine nel periodo di osservazione non è stata segnalata la comparsa di anticorpi contro MarzAA.
Durante lo studio, i ricercatori hanno anche valutato l’influenza del trattamento con MarzAA sulla sua capacità di intervenire sulla qualità della vita dei pazienti con emofilia (QoL). Prima dell’inizio del trial, i pazienti arruolati avevano un punteggio QoL medio di 44,8, come determinato dal questionario Hemophilia Quality of Life per adulti (Haem-A-QoL). Punteggio che è decisamente peggiore del 29,3 registrato dai pazienti con emofilia grave ma senza inibitori reclutati in un precedente studio di profilassi a lungo termine (A-LONG, NCT01181128). Dopo soli 50 giorni di trattamento, si sono ottenuti miglioramenti notevolmente significativi nei punteggi di Hem-A-QoL con valori inferiori a 29.
Questi risultati preliminari evidenziano una grande potenzialità del MarzAA, somministrato per via sottocutanea, nel migliorare il controllo dei sanguinamenti spontanei e la qualità della vita delle persone affette da Emofilia. Il completamento dello trial chiarirà quale spazio questo nuovo r-FVII troverà nelle strategie terapeutiche dell’Emofilia.
RIFERIMENTI
- A. Gruppo, D. Malan, J. Kapocsiet al. : Phase 1, single‐dose escalating study of marzeptacog alfa (activated), a recombinant factor VIIa variant, in patients with severe hemophilia – J.ThromHem October 2018 Volume16, Issue10Pages 1984-1993
- Levy, M. V. Kosinova, H. Khacchatryan et al. : Phase 2/3 trial of subcutaneous engineered FVIIa Marzeptacog alfa (activated) in hemophilia A or B with inhibitors: Pharmacokinetics, pharmacodynamics, efficacy and safety – Haemophilia February 2019 Vol.25, IssueS1Pages 25-3
http://ir.catalystbiosciences.com/events-and-presentations/upcomingevents?c=254141&p=irolcalendar



