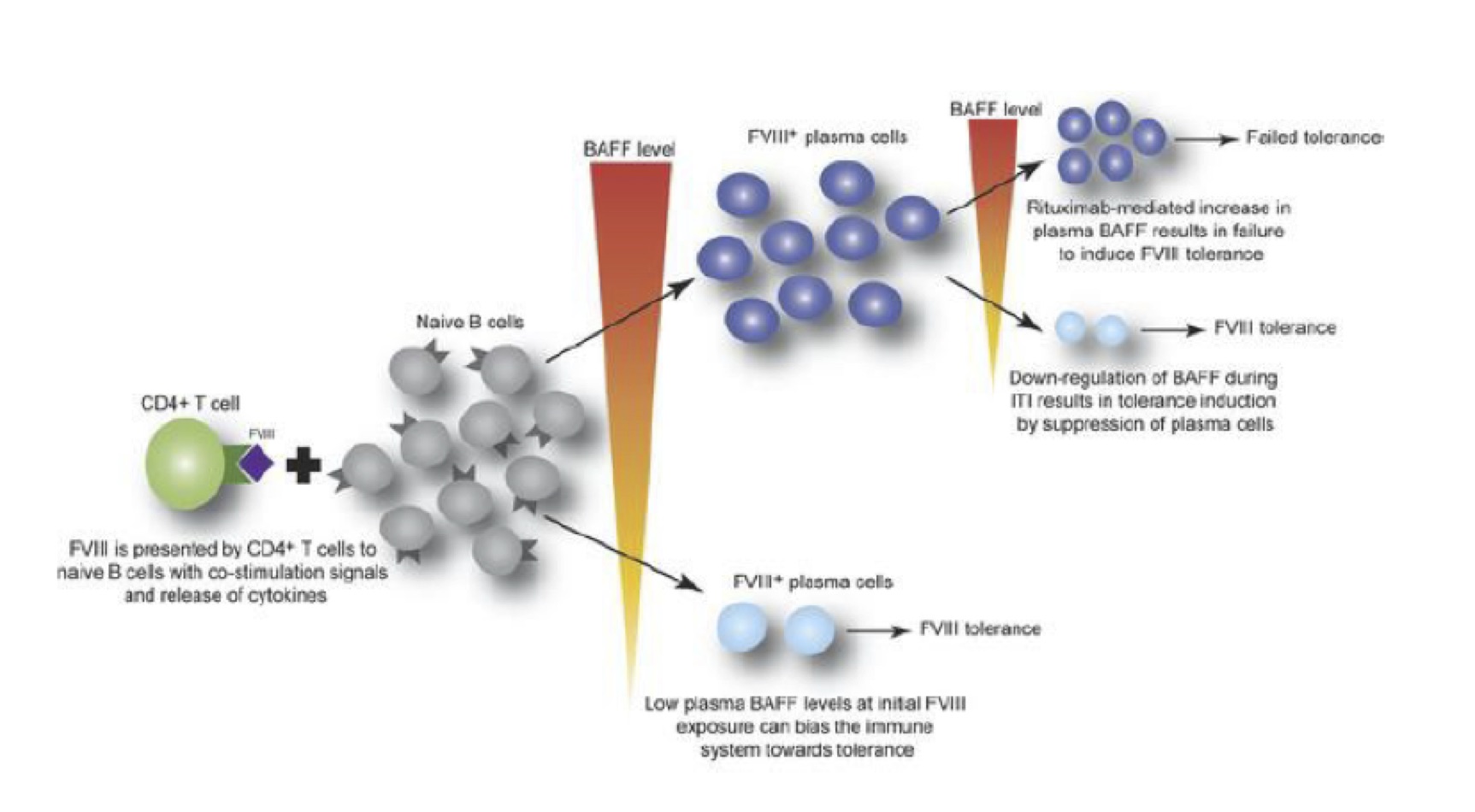
Una famiglia di citokyne (BAFF) è responsabile della differenziazione delle cellule B nella normale omeostasi e nei disordini autoimmunitari
Gli inibitori del fattore VIII (FVIII) rimangono la complicanza più difficile per la gestione della terapia sostitutiva del FVIII nell’emofilia A .
Su questo tema, ancora non risolto, si segnala un interessante lavoro comparso recentemente sul Journal of Clinical Investigation 2021;131(8): e142906
Ad oggi la terapia di elezione per l’eradicazione dell’inibitore rimane l’ITI con i suoi noti limiti sia nei risultati che nelle difficoltà di gestione della terapia stessa.
In associazione all’ITI una varietà di farmaci immunomodulatori ( come il rituxumab un anti-CD20) sono stati sperimentati in pazienti con inibitori e tutti con risultati variabili.
Comunque sia negli esseri umani la risposta anticorpale contro FVIII sembra consistere in un’azione di cellule B (linfociti) capaci di produrre anticorpi neutralizzanti (ad alta affinità, IgG4).
Abbiamo poi dimostrazione che una proteina chiamata fattore di attivazione delle cellule B (BAFF) rappresenta un regolatore chiave della differenziazione delle cellule B nella normale omeostasi. Il BAFF è responsabile della stimolazione e della sopravvivenza delle cellule B, cellule responsabili nella produzione di anticorpi per combattere le infezioni, ma ovviamente anche degli anticorpi neutralizzanti contro il FVIII.
Livelli elevati di BAFF nel flusso sanguigno sono stati riscontrati in diverse malattie autoimmuni e questo in alcuni casi ha anche portato allo sviluppo di una terapia biologica, belimumab. Quest’ultimo è un anti-BAFF, già approvato dalla FDA per il trattamento del lupus eritematoso sistemico, progettat appunto per bloccare il BAFF.
Gli autori ritengono che comprendere i meccanismi che guidano lo sviluppo dei linfociti B specifici per FVIII potrebbe aiutare a identificare i bersagli terapeutici per la gestione dell’emofilico con inibitori.
Sembra quindi consolidato il dato che la proteina di segnalazione immunitaria BAFF può promuovere la formazione di anticorpi neutralizzanti, o inibitori, contro il fattore VIII riducendo l’efficacia delle terapie sostitutive del FVIII.
Sembra dimostrato anche che i pazienti con emofilia A, che hanno sviluppato inibitori anti-FVIII, hanno nello stesso tempo alti livelli di BAFF in circolo.
I ricercatori del Children’s Hospital di Philadelphia (CHOP) si sono chiesti se BAFF possa quindi essere coinvolto nello sviluppo di inibitori del FVIII in pazienti con emofilia A.
Per rispondere a questa domanda, hanno condotto una serie di esperimenti utilizzando campioni raccolti da adulti e bambini con emofilia A, nonché modelli murini correlati a malattie.
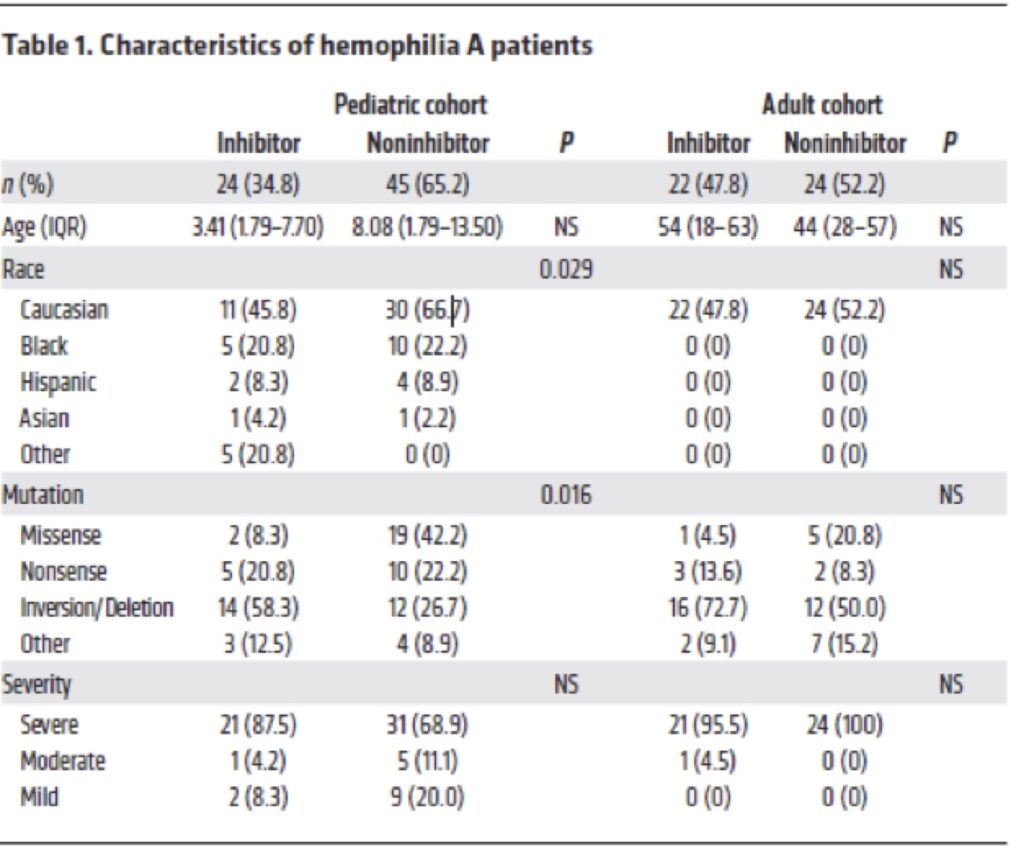
In primo luogo, hanno raccolto campioni di sangue da 69 pazienti pediatrici, 24 (34,8%) con inibitori del FVIII e 45 senza (65,2%) tab 1. Non c’era differenza di età, razza o gravità della malattia tra quelli con e senza inibitori. Dei 69 partecipanti, solo due erano donne e nessuno dei due aveva inibitori.
Le analisi hanno mostrato che i livelli di BAFF erano più alti nei bambini con inibitori rispetto a quelli senza inibitori 1,30 ng/mL vs 0,99 ng/mL.
Inoltre, nei pazienti che sono stati sottoposti a ITI e hanno raggiunto la tolleranza, i livelli di BAFF sono diminuiti da 1,43 ng/mL al basale (prima dell’inizio del trattamento) a 0,81 ng/mL dopo il trattamento. Al contrario, i livelli di BAFF sono rimasti alti in coloro che non hanno raggiunto la tolleranza.
Allo stesso modo, in un gruppo di 46 adulti con emofilia A, 22 (47,8%) con inibitori e 24 (52,2%) senza, i livelli di BAFF erano più alti in quelli che avevano inibitori (1,14 contro 1,03 ng/ml).
Successivamente, hanno valutato se un aumento del BAFF, dopo la terapia a base di rituximab, sia in grado di precludere alla tolleranza del FVIII, come visto in altri contesti di malattie allo e autoimmuni.
Il team ha misurato i livelli di BAFF in campioni di sangue ottenuti da 17 pazienti con emofilia A con inibitori. Di questi, nove sono stati arruolati in uno studio clinico che valutava il solo rituximab somministrato in coloro che non erano riusciti in precedenza a raggiungere la tolleranza basata solo sull’ITI. gli altri otto hanno partecipato a uno studio in cui invece è stata loro somministrata la stessa dose di rituximab in combinazione con ITI.
Tre dei 17 pazienti (17%) hanno raggiunto la tolleranza: uno dopo essere stato trattato con solo rituximab e due dopo aver ricevuto una combinazione di rituximab e ITI
Nei 14 pazienti che non hanno raggiunto la tolleranza, i livelli di BAFF sono aumentati di tre volte rispetto al basale (da 0,89 a 2,66 ng / ml). Sebbene i livelli di BAFF siano aumentati anche in coloro che hanno raggiunto la tolleranza (da 0,78 a 2,60 ng / ml), il basso numero di casi ha limitato il confronto statistico.
Successivamente, il team ha verificato se il blocco del BAFF con un anticorpo anti-BAFF (simile a belimumab) potesse prevenire o eliminare la produzione di inibitori del FVIII in due modelli murini di emofilia A.
A un ceppo di topo con emofilia è stato somministrato un anticorpo anti-BAFF, o un controllo, prima dell’immunizzazione con FVIII umano. Solo tre dei 14 topi trattati con anti-BAFF hanno sviluppato inibitori rispetto a nove dei 10 animali nel gruppo di controllo, indicando che la terapia anti-BAFF ha ridotto il rischio di formazione di inibitori del 23%.
La tolleranza a lungo termine è stata testata iniettando ripetutamente questi topi con FVIII umano 22 settimane dopo il trattamento anti-BAFF. La metà dei topi ha sviluppato inibitori di alto livello (titolo), mentre i topi rimanenti avevano bassi livelli di inibitore.
Pertanto il team dei ricercatori sostiene l’ipotesi che una singola dose di anticorpo anti-BAFF è stata sufficiente per prevenire la formazione di inibitori ad alto titolo nei topi con emofilia A, con un effetto prolungato (più di 22 settimane) oltre il relativo breve periodo iniziale di riduzione dei livelli BAF.
Una secondo modello murino è stato utilizzato per valutare gli effetti della terapia anti-BAFF in animali con inibitori comparsi prima di un qualunque pretrattamento. I topi sono stati successivamente trattati con un solo anticorpo anti-CD20 (un agente di deplezione delle cellule B simile al rituximab), con un anti-BAFF da solo o con entrambi.
Le analisi hanno mostrato che i topi trattati solo con un anti-BAFF presentavano una riduzione di BAFF. I topi trattati con anticorpi anti-CD20 avevano al contrario un aumento di tre volte nei livelli di BAFF, e questo aumento veniva corretto dall’ aggiunta di un anti-BAFF .
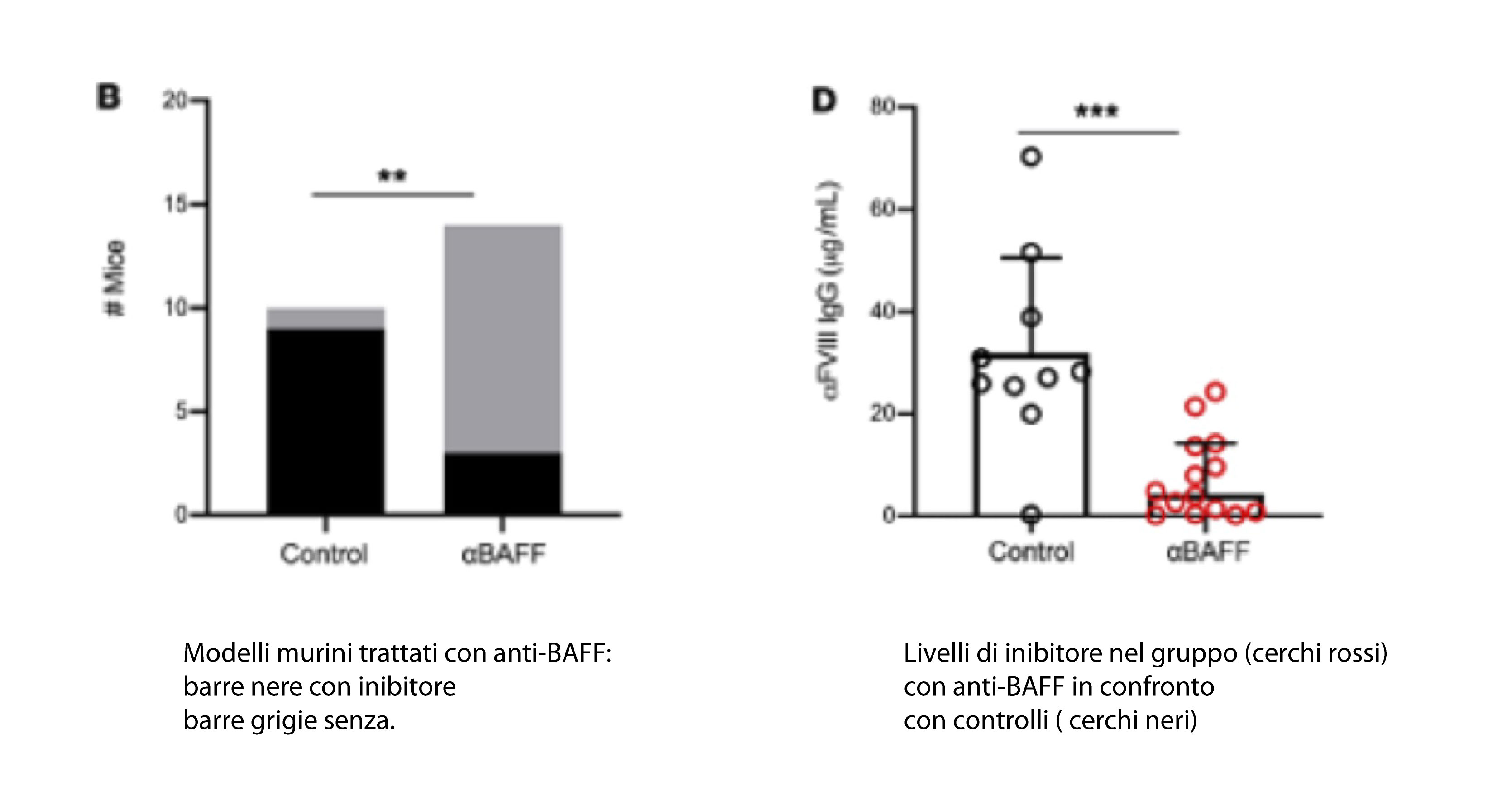
Tuttavia segnalano che solo la terapia di associazione ha determinato una sostanziale diminuzione dei livelli di inibitore rispetto ai controlli, anche dopo ripetute iniezioni di FVIII umano. Questi dati suggeriscono quindi ulteriormente che BAFF può regolare la generazione e il mantenimento degli inibitori del FVIII, permettendo ai linfociti B di produrre anti-FVIII.
Questo studio, a detta degli stessi autori, ha alcune limitazioni. In primo luogo, ci sono probabilmente differenze nella risposta immunitaria tra gli adulti ed i pazienti pediatrici, le cui risposte immunitarie potrebbero essere ancora in evoluzione, come notato nello studio HIPS di Reipert et al . Comunque, l’aumento del BAFF nella popolazione emofilica adulta con inibitori rappresenta una conferma dell’ipotesi che BAFF moduli la risposta immunitaria del fattore VIII.
In secondo luogo, i topi sono geneticamente più omogenei tra di loro rispetto all’uomo; per minimizzare questa differenza è stata utilizzata una varietà di reagenti anticorpali e 2 diversi ceppi di topi affetti da emofilia A. Infine la risposta immunitaria anti-FVIII studiata nei topi è una risposta ad una xenoproteina e quindi potrebbe non essere direttamente applicabile a l’esperienza umana.
Tuttavia, poiché entrambi sono alloanticorpi e dato che la maggior parte dei pazienti con inibitori non produce FVIII endogeno, si può ritenere che caratterizzare la risposta al FVIII in un modello murino fornisce informazioni preziose sia sulla formazione che su possibili strategie terapeutiche mirate agli anticorpi umani α-FVIII.
In sintesi, i dati di questo lavoro suggerirebbero l’utilità di utilizzare la terapia [anti-BAFF, belimimab] in combinazione con la terapia [anti-CD20 rituximab] per l’eradicazione degli inibitori del FVIII nei pazienti con emofilia A.In effetti sono in corso terapie con questa logica in contesti di malattie autoimmuni negli adulti (NCT02631538, NCT02260934, NCT03967925, NCT03747159, ecc.). Ovviamente sono necessari ulteriori studi volti a comprendere il meccanismo esatto di questa risposta e la sua persistenza nel tempo. Sarà altrettanto utile determinare anche eventuali varianti genetiche BAFF utili ad identificare i pazienti ad alto rischio di sviluppo di inibitori e / o di fallimento di ITI.
Per approfondire
Reipert BM, et al. The prospective hemophilia inhibitor PUP study reveals distinct antibody signatures prior to FVIII inhibitor development. Blood Adv. 2020;4(22):5785–5796.
Bhavya S. Doshi et al. B cell–activating factor modulates the factor VIII immune response in hemophilia A Clin Invest. 2021;131(8):e142906
Smulski CR, Eibel H. BAFF and BAFF-receptor in B cell selection and survival. Front Immunol. 2018;9:2285.
Gheita TA, et al. Elevated BAFF (BLyS) and APRIL in Juvenile idiopathic arthritis patients: relation to clinical manifestations and diseaseactivity. Joint Bone Spine. 2012;79(3):285–290.
Navarra SV, et al. Efficacy and safety of belimumab in patients with active systemic lupus erythematosus: a randomised, placebo-controlled, phase 3 trial. Lancet. 2011;377(9767):721–731
Thai LH, et al. BAFF and CD4+ T cells are major survival factors for long-lived splenic plasma cells in a B-cell-depletion context. Blood. 2018;131(14):1545–1555.
Ehrenstein MR, Wing C. The BAFF ling effects of rituximab in lupus: danger ahead? Nat Rev Rheumatol. 2016;12(6):367–372.
Scholz JL, et al. BLyS inhibition eliminates primary B cells but leaves natural and acquired humoral immunity intact. Proc Natl Acad Sci U S A. 2008;105(40):15517–15522.
Kowalczyk-Quintas C, et al. Antibodies that block or activate mouse B cell activating factor of the tumor necrosis factor (TNF) family (BAFF), respectively, induce B cell depletion or B cell hyperplasia. J Biol Chem. 2016;291(38):19826–19834.



