Studio sulla Sicurezza ed Efficacia di un Fattore VIII Ricombinante Pegilato nei Bambini
La terapia sostitutiva con fattore VIII (FVIII) è lo standard di cura per l’emofilia A grave e oggi i ricombinanti con emivita prolungata offrono la possibilità di migliorare l’aderenza ai piani terapeuti con infusioni meno frequenti rispetto ai prodotti standard.
Haemophilia, nel suo primo numero del 2020, ha pubblicato un’interessante esperienza condotta nei bambini con emofilia A grave con un fattore VIII ricombinante PEGilato e B deleto ad emivita prolungata (BAY 94-9027).
Il BAY 94-9027 (damactocog alfa pegol; Jivi® Bayer. 3) nel PROTECT, uno studio multicentrico randomizzato di fase II/III, ha dimostrato, con somministrazioni ad intervalli prolungati superiori a 7 giorni, la sua efficacia nella prevenzione e nel trattamento degli episodi emorragici in soggetti adolescenti ed adulti con emofilia A grave.
Dobbiamo tuttavia considerare che la farmacocinetica del FVIII nei bambini presenta in generale una ridotta half-life e una più rapida clearance rispetto ai soggetti adulti. Questo impone ovviamente che si valutino tali parametri per ottimizzare le indicazioni terapeutiche in una popolazione composta di solo piccoli pazienti.
BAY 94-9027 ha un’emivita di 19 ore negli adulti e negli adolescenti che si riduce a 15-16 ore nei bambini di età inferiore a 12 anni. Quadri simili sono riscontrabili anche in altri prodotti analoghi presenti in commercio. Questi differenti comportamenti, nei piccoli pazienti, vengono messi in relazione prevalentemente alla loro iperattività motoria. I clinici, dunque, ritengono importante valutare, con studi clinici, tali comportamenti quando si debba, in tali categorie, andare a determinare i dosaggi più appropriati per la profilassi che è di estrema importanza per la prevenzione dell’artropatia cronica.
Lo studio PROTECT VIII Kids ha mirato dunque a valutare l’efficacia e la sicurezza di BAY 94-9027 in soggetti, già precedentemente trattati con altri prodotti, di età inferiore ai 12 anni.
Il PROTECT VIII Kids è stato disegnato come uno studio multicentrico, aperto di fase 3, (NCT01775618), condotto dal maggio 2013 a marzo 2015 e suddiviso in due parti.
Nello studio principale (parte 1), i pazienti sono stati trattati con BAY 94-9027 con uno dei tre dosaggi raccomandati per almeno 50 giornate di esposizione e per un minimo di 6 mesi. I dosaggi sono stati estrapolati dall’esperienza condotta in adolescenti e adulti negli studi PROTECT VIII di fase 1 e fase 2/3. I dosaggi iniziali raccomandati sono stati di 25 UI / kg due volte alla settimana, 45 UI / kg ogni 5 giorni o 60 UI / kg ogni 7 giorni. Per protocollo, la dose o la frequenza della dose poteva essere modificata in qualsiasi momento.
Nello studio principale (parte 1), i pazienti sono stati trattati con BAY 94-9027 con uno dei tre dosaggi raccomandati per almeno 50 giornate di esposizione e per un minimo di 6 mesi. I dosaggi sono stati estrapolati dall’esperienza condotta in adolescenti e adulti negli studi PROTECT VIII di fase 1 e fase 2/3. I dosaggi iniziali raccomandati sono stati di 25 UI / kg due volte alla settimana, 45 UI / kg ogni 5 giorni o 60 UI / kg ogni 7 giorni. Per protocollo, la dose o la frequenza della dose poteva essere modificata in qualsiasi momento.
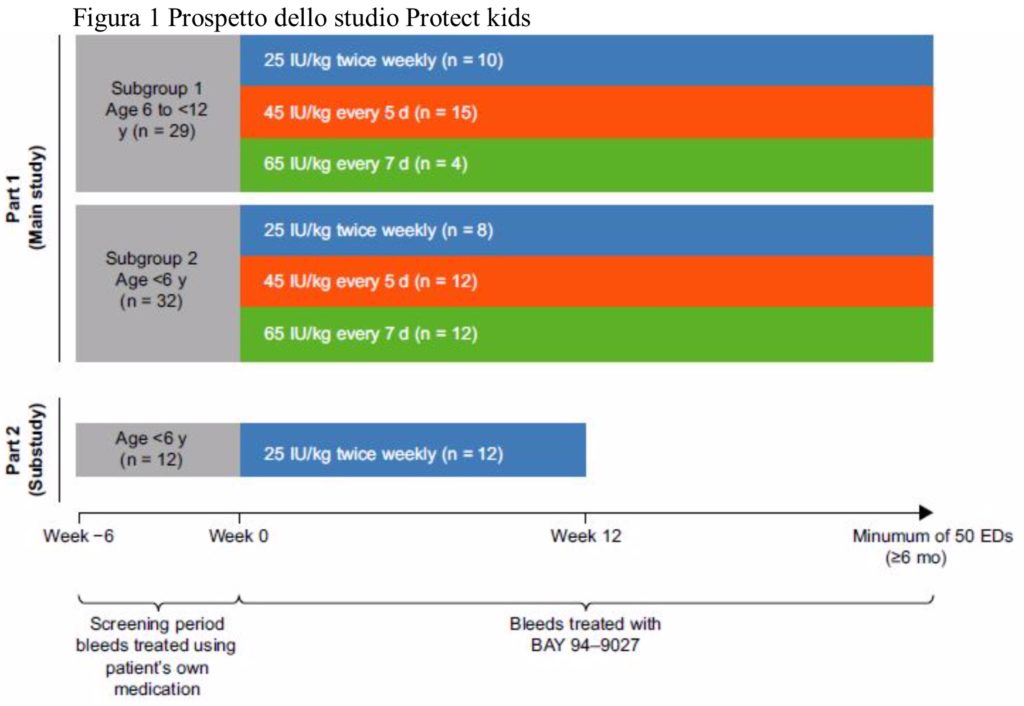
I soggetti in profilassi con una sola somministrazione alla settimana avevano la possibilità di aumentare la frequenza delle infusioni ma non quella di aumentare la dose totale settimanale. I pazienti trattati due volte alla settimana avevano la possibilità solo di aumentare la loro dose, mentre quelli trattati ogni 5 giorni potevano aumentare o la frequenza o la dose.
Nello studio secondario (parte 2) della durata di 12 settimane sono stati arruolati ulteriori 12 bambini di età inferiore ai 6 anni con l’obbiettivo di ottenere ulteriori informazioni sulla sicurezza di un regime terapeutico caratterizzato da una frequenza con intervalli più ristretti rispetto ai piccoli pazienti del gruppo 1.
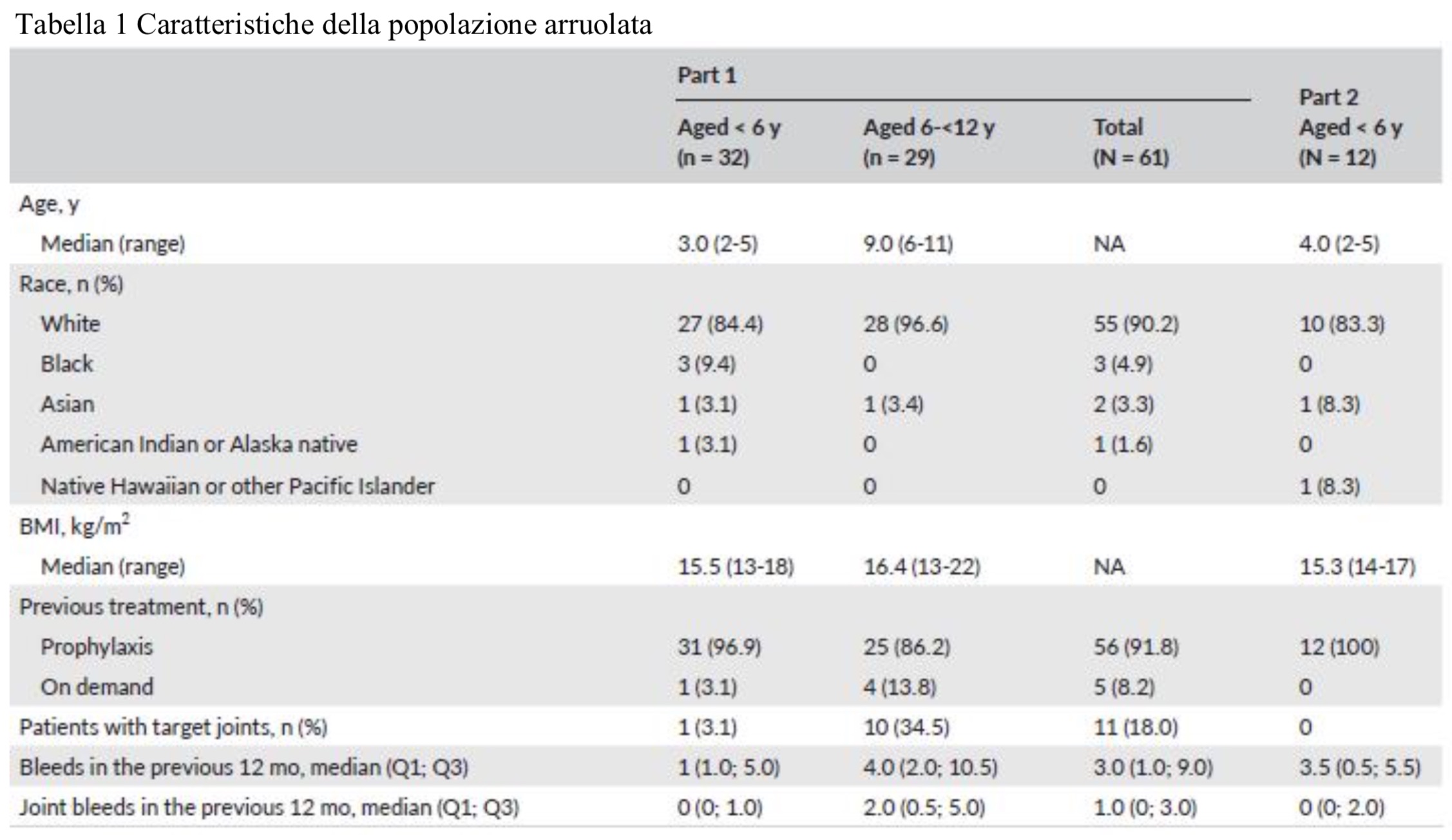
In sintesi sono stati arruolati 31 pazienti provenienti da 13 paesi; nello studio principale (parte 1) troviamo 32 soggetti di età inferiore a 6 anni e 29 soggetti di età tra 6 e 12 anni. Nel sottogruppo (parte2) invece sono stati inseriti 12 piccoli pazienti con meno di 6 anni.
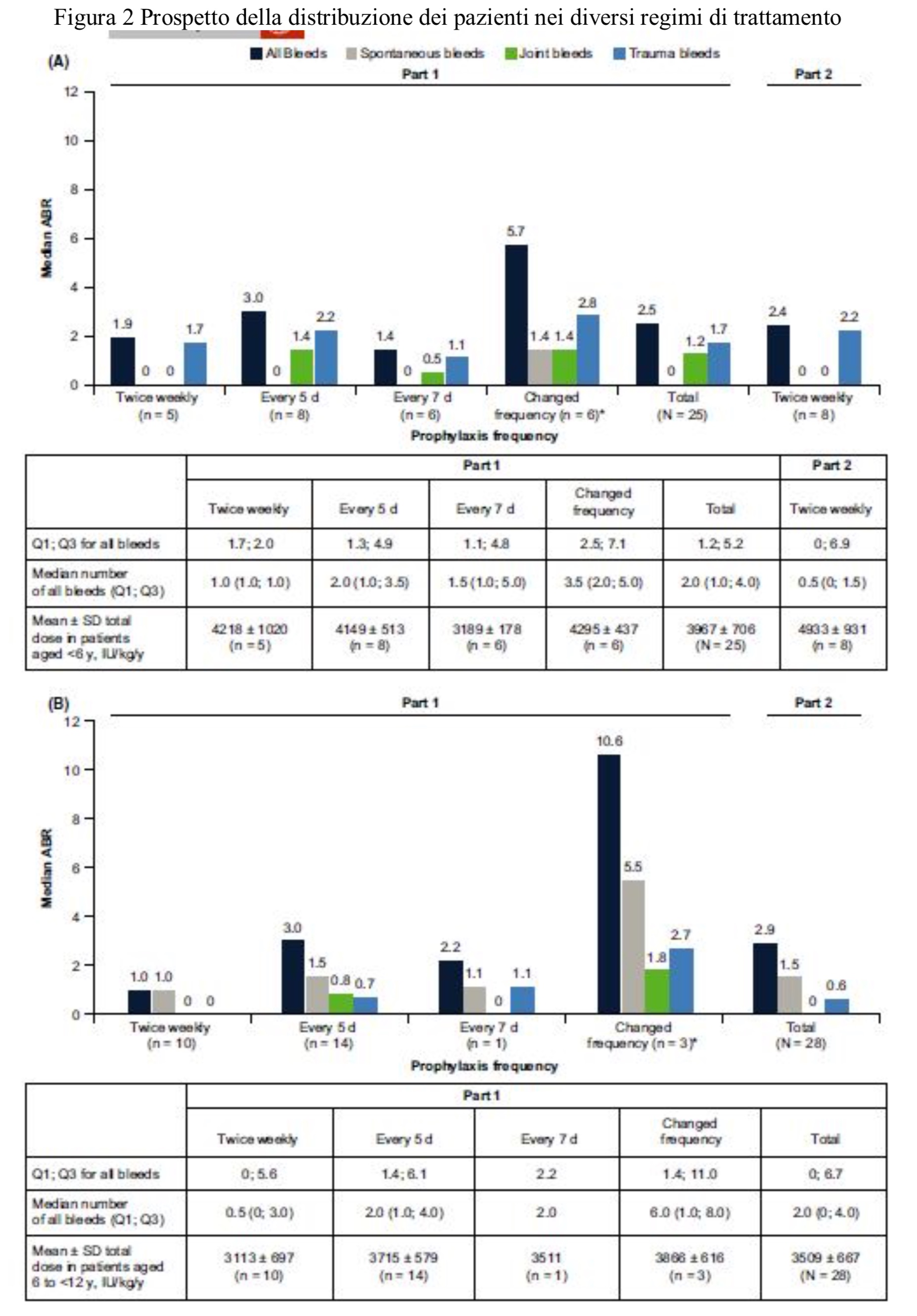
Al termine dello studio, 25 pazienti sono stati trattati due volte alla settimana, 28 ogni 5 giorni e 8 ogni 7 giorni. L’ABR mediano per tutti i sanguinamenti è stato di 2.9 (Parte 1) e 2.4 (Parte 2) con nessuna differenza tra i pazienti più giovani e quelli più anziani. Dodici pazienti (22.6%) non hanno presentato sanguinamenti: 4 avevano meno di 6 anni ed 8 tar 6 e 12 anni.
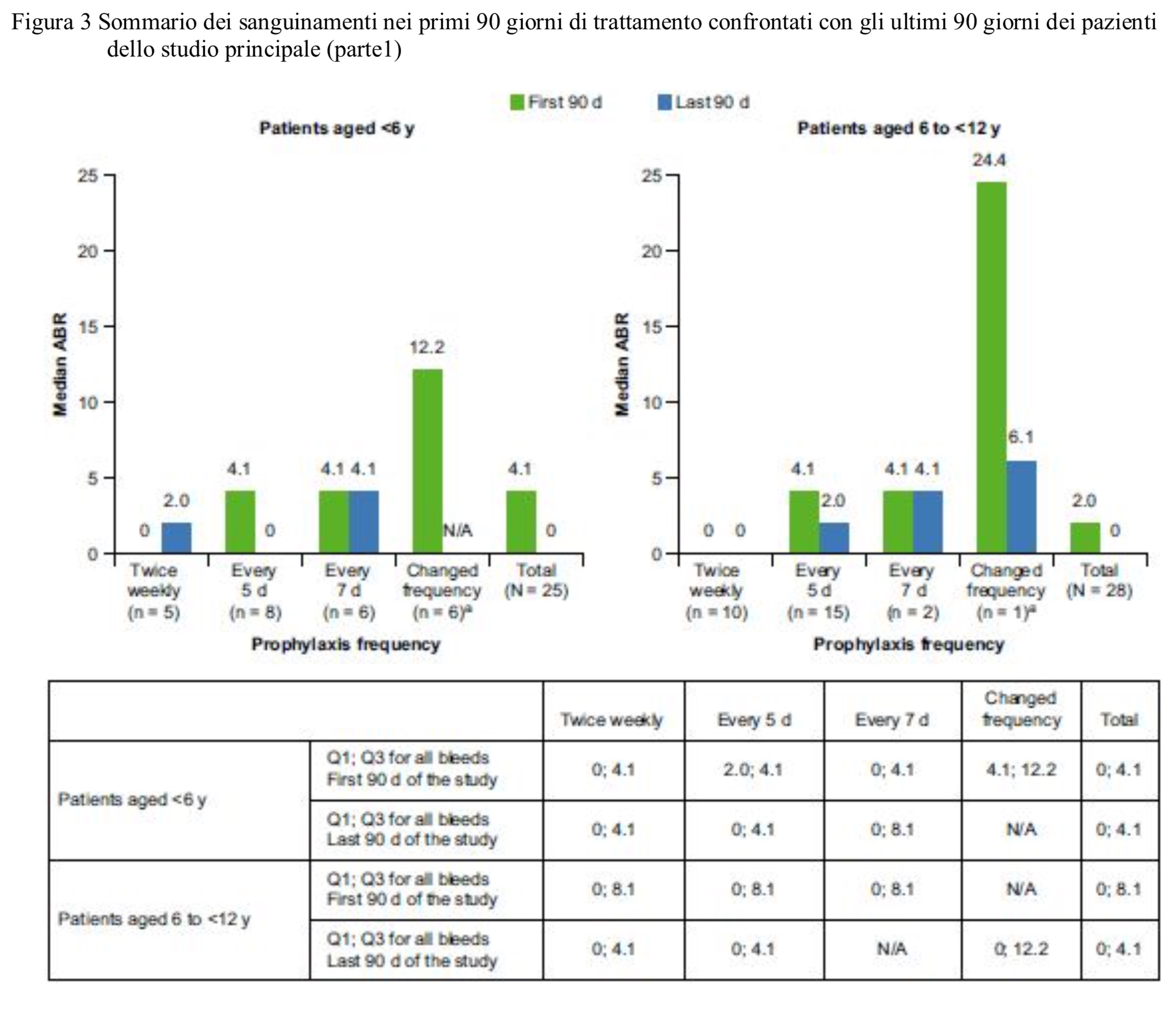
Negli ultimi 90 giorni di trattamento dei pazienti inseriti nello studio principale la ABR mediana era 0 per entrambe le classi di età( < 6anni e 6 <> 12anni). Sempre in questo gruppo di pazienti sono stati osservati 149 sanguinamenti e di questi il 93% è stato controllato con una o due infusioni. Non sono stati segnalati lo sviluppo di inibitori del FVIII.
RIFERIMENTI
- European Medicines Agency. Jivi summary of product characteristics. 2018 https://www.ema.europa.eu/en/docum ents/produ ct-infor matio n/jivi-epar-produ ct-infor mation_en.pdf
- Shah A, Coyle T, Lalezari S, et al. BAY 94–9027, a PEGylated re combinant factor VIII, exhibits a prolonged half-life and higher area under the curve in patients with severe haemophilia A: comprehen sive pharmacokinetic assessment from clinical studies. Haemophilia. 2018;24(5):733-740.
- Mei B, Pan C, Jiang H, et al. Rational design of a fully active, long-acting PEGylated factor VIII for hemophilia A treatment. Blood. 2010;116(2):270-279.
- Reding MT, Ng HJ, Poulsen LH, et al. Safety and efficacy of BAY 94–9027, a prolonged-half-life factor VIII. J Thromb Haemost. 2017;15(3):411-419.
- Iorio A, Iserman E, Blanchette V, et al. Target plasma factor levels for personalized treatment in haemophilia: a Delphi consensus statement. 2017;23(3):e170-e179
- Coyle TE, Reding MT, Lin JC, Michaels LA, Shah A, Powell J. Phase I study of BAY 94–9027, a PEGylated B-domain-deleted recombinant factor VIII with an extended half-life, in subjects with hemophilia A. J Thromb Haemost. 2014;12(4):488-496
- Santagostino E, Kenet G,Fischer K,Biss T,Ahuja S, Sanjay A, Steele M , PROTECT VIII Kids: BAY 94-9027 (PEGylated RecombinantFactor VIII) safety and efficacy in previously treated children with severe haemophilia A, Haemophilia. 2020;00:1–11.



