Lo studio “aspire” ha osservato per circa quattro anni i pazienti in profilassi con il rFVIIIFc
La profilassi a lungo termine è oggi, dai clinici, unanimamente considerata fondamentale per la prevenzione dell’artropatia cronica nei pazienti emofilici. La profilassi assicura una qualità di vita di alto standard anche in proiezione di una aspettativa di vita simile a quella della popolazione generale.
Tuttavia i piani terapeuti per la profilassi sono condizionati oltre che dallo stile di vita e dal fenotipo dei pazienti anche dalla farmacocinetica dei prodotti utilizzati.
La breve emivita del fattore VIII e la conseguente necessità di frequenti trattamenti hanno rappresentato per i pazienti uno dei maggiori ostacoli per una corretta aderenza ai piani terapeutici.
Recentemente sono comparsi sul mercato prodotti con modificazioni strutturali (definiti a prolungata emivita [EHL] extended half-life) con l’obbiettivo di ridurre la clearance e di conseguenza la frequenza dei trattamenti.
Nel recente studio di fase 3 A-Long (NCT01181128) dedicato ai soggetti adulti e in quello progettato per i piccoli pazienti Kids A-LONG (NCT01458106) è già stata dimostrata l’efficacia e la sicurezza del rFVIIIFc.
Il rFVIIIFc è stato sviluppato legando a una molecola del fattore VIII, con delezione del dominio B, la porzione Fc dell’immunoglobulina umana IgG1.
Il rFVIIIFc, prodotto in una linea cellulare umana privo di additivi animali e umani, è costituito da una singola molecola monomerica di FVIII ricombinante fuso al dominio Fc dell’immunoglobulina G1; quest’ultimo si lega al recettore Fc neonatale e prolunga l’emivita del FVIII.
L’esperienza, che qui vi riassumiamo, ha avuto come obiettivo la sicurezza e l’efficacia a lungo termine del rFVIIIFc in soggetti con emofilia A grave.
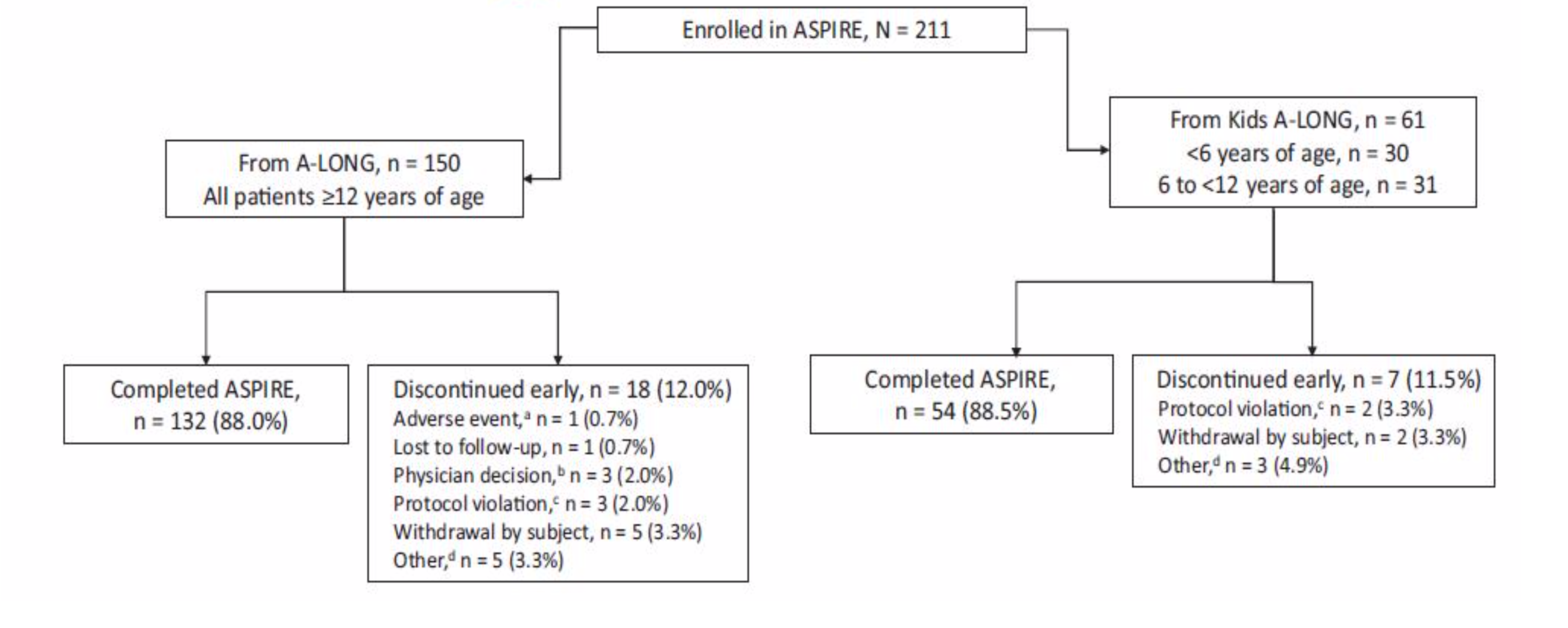
Questo studio chiamato ASPIRE (NCT 01454739), un’estensione dell’A-LONG, ha avuto le caratteristiche di essere aperto e non randomizzato. I pazienti arruolati sono stati coloro che avevano completato lo studio di fase 3 sia con età superiore ai 12 anni che con meno di 12 anni.
L’obiettivo è stato quello di confermare nel lungo periodo la sicurezza e l’efficacia del rFVIIIFc nei soggetti con emofilia A grave.
I soggetti arruolati hanno ricevuto diversi regimi terapeutici che possiamo riassumere come segue: a) una profilassi individualizzata (IP), b) una profilassi settimanale(WP), c) profilassi modificata (MP) o a domanda (ET). Categorie non rigide, infatti i pazienti avevano in ogni caso la possibilità di cambiare regime terapeutico in qualsiasi momento.
Tab. 1 : la popolazione arruolata
Il piano terapeutico della profilassi di ogni singolo paziente si è basato sullo studio farmacocinetico, sul profilo clinico osservato nello studio di origine A-Long e sulle osservazioni dei valori di recupero del FVIII durante l’osservazione nel corso dello studio ASPIRE.
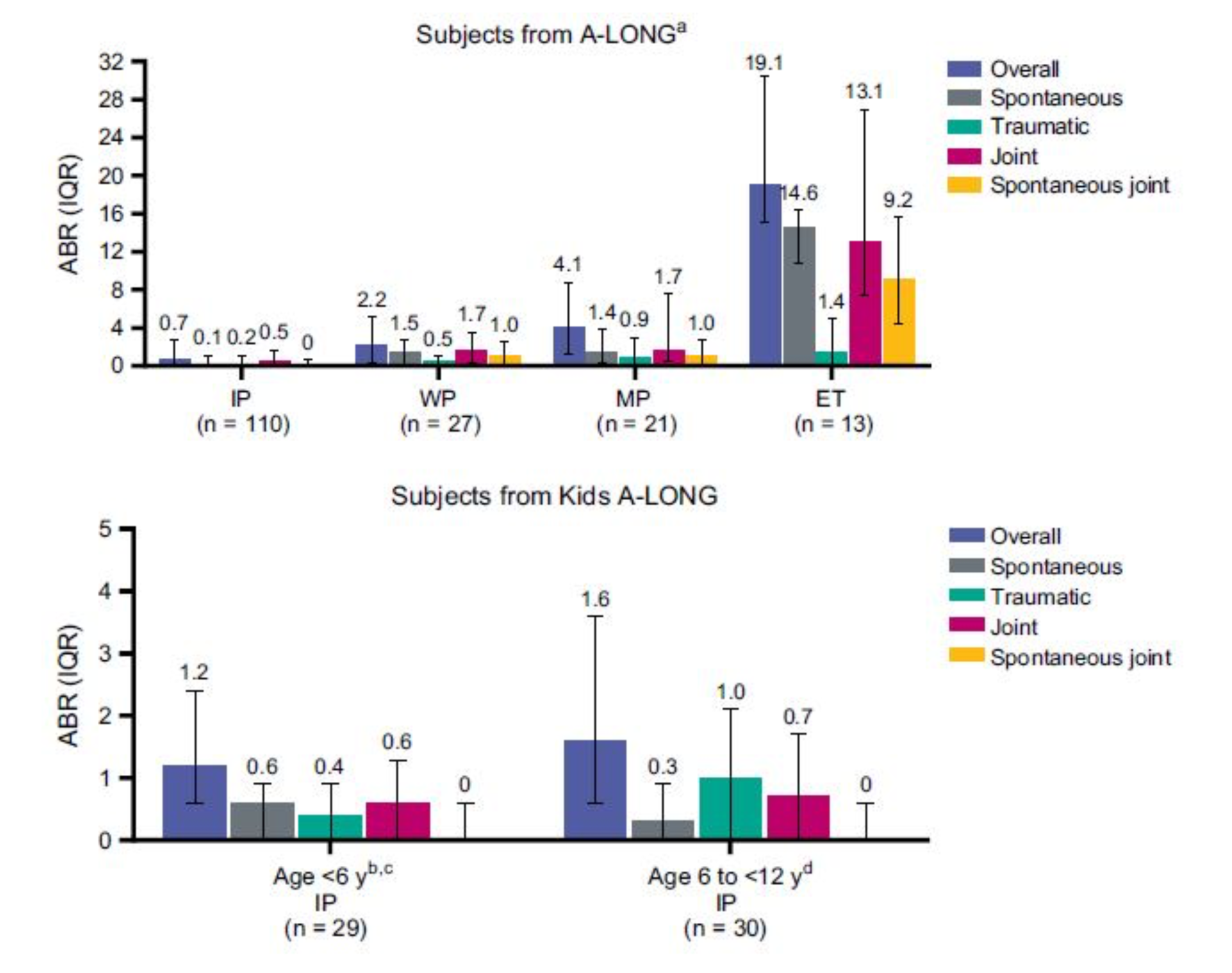
Al gruppo IP è stata assegnata una dose di rFVIIIFc ad intervalli tali da far mantenere l’attività del FVIII plasmatico di circa il 5%. Questo gruppo era suddiviso in un primo sottogruppo, in terapia ogni 3 o 5 giorni, con 25/65UI/Kg per trattamento, nel secondo in terapia 2 volte a settimana con un dosaggio stabilito in 20/65 UI/Kg. nel giorno 1° e 40/65 UI/Kg nel giorno 4° della settimana. Il gruppo WP ha ricevuto invece 65 UI/kg di rFVIIIFc settimanali.
Nel gruppo ET, la dose è stata determinata basandosi sulla valutazione clinica della gravita e sul tipo di sanguinamento.
I pazienti con meno di 12 anni sono stati inseriti nel gruppo IP o WP e prevalentemente il loro schema terapeutico è stato di 80UI/Kg ad intervalli di 2 giorni.
Tutti i soggetti sono stati seguiti per un periodo che valutasse circa 100 EDs (giorni di esposizione) al rFVIIIFc o almeno 4 anni di osservazione.
Non sono stati osservati inibitori (0 per 1000 soggetti-anno; intervallo di confidenza al 95%, 0-5.2) e il profilo di sicurezza complessivo di rFVIIIFc era coerente con gli studi precedenti. Per i soggetti in regime di PI, i tassi di sanguinamento annualizzati (ABR) sono rimasti bassi (la mediana ABR complessiva per adulti e adolescenti era <1,0) e per la maggior parte dei soggetti sono stati confermati gli intervalli prolungati di somministrazione (mediana di 3,5 giorni).
Conclusione: i risultati di ASPIRE, che includono fino a 5 anni di dati di follow-up, confermano i precedenti risultati sulla sicurezza e l’efficacia del rFVIIIFc nel trattamento dell’emofilia A grave nel lungo periodo.
Tab.2 Regime terapeutico e ABR
RIFERIMENTI
- National Hemophilia Foundation. MASAC document 241: MASAC recommendations concerning Prophylaxis. https://www.hemop
- Castaman G, Linari S. Prophylactic versus on-demand treatments for hemophilia: advantages and drawbacks. Expert Rev Hematol. 2018;11:567-576.
- Peyvandi F, Garagiola I, Boscarino M, Ryan A, Hermans C, Makris M. Real-life experience in switching to new extended half-life products at European haemophilia centres. Haemophilia. 2019;25(6):946-952.
- Hacker MR, Geraghty S, Manco-Johnson M. Barriers to compliance with prophylaxis therapy in haemophilia. Haemophilia.2001;7:392-396.
- Mahdi AJ, Obaji SG, Collins PW. Role of enhanced half-life factorVIII and IX in the treatment of haemophilia. Br J Haematol. 2015;169:768-776.
- Peters RT, Toby G, Lu Q, et al. Biochemical and functional characterization of a recombinant monomeric factor VIII-Fc fusion protein. J Thromb Haemost. 2013;11:132-141.
- Bioverativ Therapeutics Inc. ELOCTATE® Prescribing Information. https://www.eloct ate.com/_asset s/pdf/eloct ate_pi.pdf. AccessedFebruary 04, 2019.
- Swedish Orphan Biovitrum AB (publ). Elocta: Summary of Product Characteristics. https://www.ema.europa.eu/en/docum ents/product-infor matio n/eloct a-epar-produ ct-infor mation_en.pdf. Accessed September 06, 2019.



